引用本文: 韓冰, 劉蘇. 芬戈莫德對視網膜光損傷大鼠光感受器細胞及小膠質細胞的影響. 中華眼底病雜志, 2015, 31(2): 169-172. doi: 10.3760/cma.j.issn.1005-1015.2015.02.015 復制
芬戈莫德(FTY720)是一種新型的免疫抑制劑,在多種自身免疫疾病、器官移植等疾病模型中均顯示出良好的免疫抑制效果[1, 2]。除了強大的免疫抑制效應外,FTY720還存在著其他的非免疫抑制效應[3, 4]。有研究發現,FTY720在多發性硬化動物模型中,能夠起到抑制小膠質細胞活化的作用,并且減少小膠質細胞產生的炎癥因子[5]。而小膠質細胞在視網膜光損傷中大量活化并遷移,在光損傷過程中發揮重要作用[6]。但目前就FTY720在視網膜光損傷中的作用研究還不太多,為了探討FTY720是否對視網膜光損傷后光感受器細胞具有保護作用及其可能的作用機制,我們觀察了FTY720對視網膜光損傷后凋亡細胞的抑制作用及其對小膠質細胞的影響。現將結果報道如下。
1 材料和方法
Sprague-Dawley大鼠120只,雌雄各半,6~8周齡,體重250~300 g,四川省人民醫院實驗動物研究所提供。原位末端標記(TUNEL)試劑盒(瑞士Roche公司),小膠質細胞流式Iba-1-異硫氰酸熒光素(FITC)抗體及同型對照抗體(美國Abcom公司),磷酸鹽緩沖液(PBS,美國Thermo公司),酶聯免疫吸附試驗(ELISA)試劑盒(美國RG公司),新生牛血清(美國Gibco公司)。流式細胞儀(美國Beckman公司)。
將大鼠隨機分為正常組、模型組、溶媒組和FTY720組,每組30只。正常組大鼠不予處理;模型組、溶媒組和FTY720組大鼠建立光損傷動物模型。模型組大鼠僅接受光照。FTY720組大鼠建模前0.5 h以10 mg/kg的劑量腹腔注射FTY720,溶媒組大鼠注射50%二甲基亞砜。自制大小140 cm×57 cm×119 cm的木箱,側面留通風孔;頂部安裝3根可調節亮度的白色熒光燈管,其余各面貼閃光紙,使木箱中光照均勻;調節光照強度為(2700±100)Lux,溫度控制在20~30℃。模型組、溶媒組和FTY720組大鼠出生后即在微弱循環光(5 Lux明適應12 h及暗適應12 h)環境下飼養至6~8周大小。光照前暗適應12 h后放入光損傷箱內接受白光照射6 h,在光照3 h時兩側均互相調換位置。光照結束后放回原飼養環境中喂養。
光照后6 h及1、3、7 d,斷頸處死各組大鼠,分離視網膜,剪碎,過200目不銹鋼濾網,收集濾液,離心,獲得單細胞懸液。將密度分別為1.030、1.072、1.088、1.123 g/ml的Percoll細胞分離液依次添加在細胞懸液上,離心吸取1.072、1.088 g/ml兩層細胞懸液,加Iba-1-FITC抗體孵育后應用流式細胞儀檢測視網膜中小膠質細胞所占比例。
光照后6 h及1、3、7 d,斷頸處死各組大鼠,分離視網膜,制成勻漿,將標本保存在液氮中,待標本采集完成后,按照ELISA試劑盒操作說明書檢測大鼠視網膜中白細胞介素(IL)-1β的含量。
光照后1 d,斷頸處死各組大鼠,摘取眼球,在12點鐘方向結膜連接視盤處做標記。常規固定、脫水、石蠟包埋、切片,按照TUNEL試劑盒進行染色,以棕黃色染色細胞為凋亡細胞。光學顯微鏡下采集圖片,計數凋亡細胞。
光照后7 d,斷頸處死各組大鼠,摘取眼球,在12點鐘方向結膜連接視盤處做標記。常規固定、脫水、石蠟包埋、切片,行蘇木精-伊紅(HE)染色,光學顯微鏡下觀察大鼠視網膜神經節細胞層(GCL)、內核層(INL)、外核層(ONL)等各層次形態結構。
采用SPSS 17.0軟件進行統計學分析。計量資料均以均數±標準差(
2 結果
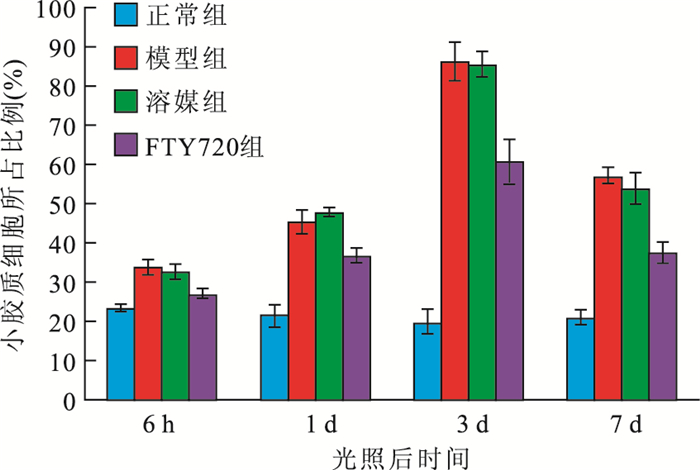
流式細胞儀檢測結果顯示,大鼠視網膜中小膠質細胞所占比例于光照后6 h開始升高,光照后3 d達高峰,光照后7 d開始下降。正常組、模型組、溶酶組及FTY720組大鼠視網膜中小膠質細胞所占比例分別為24.40%、80.00%、74.40%、51.30%。光照后6 h及1、3、7 d,FTY720組大鼠視網膜中小膠質細胞所占比例均較模型組、溶酶組降低,較正常組升高,差異均有統計學意義(F=53、134、240、185,P<0.01)(圖 1)。
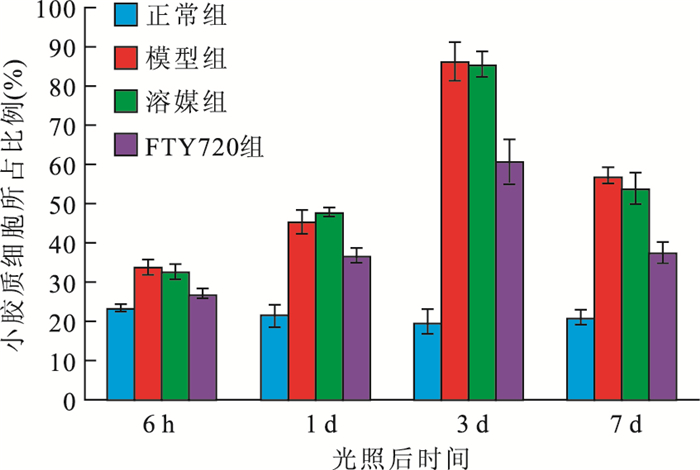 圖1
光照后不同時間點各組大鼠視網膜中小膠質細胞所占比例比較
圖1
光照后不同時間點各組大鼠視網膜中小膠質細胞所占比例比較
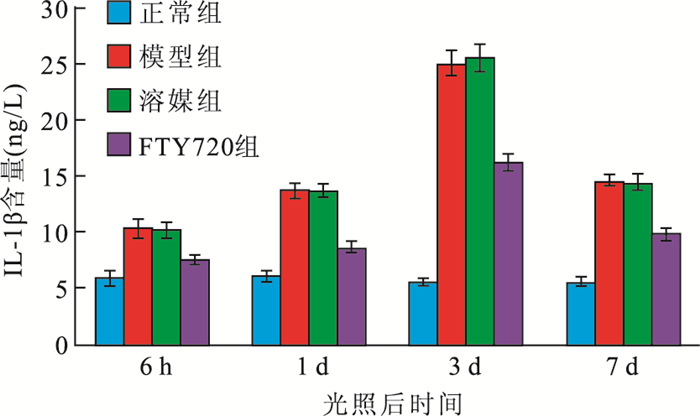
ELISA檢測結果顯示,光照后大鼠視網膜中IL-1β含量的變化趨勢與小膠質細胞所占比例變化趨勢一致。光照后6 h及1、3、7 d,FTY720組大鼠視網膜中IL-1β含量均較模型組、溶酶組降低,較正常組升高,差異均有統計學意義(F=53、275、581、429,P<0.01)(圖 2)。
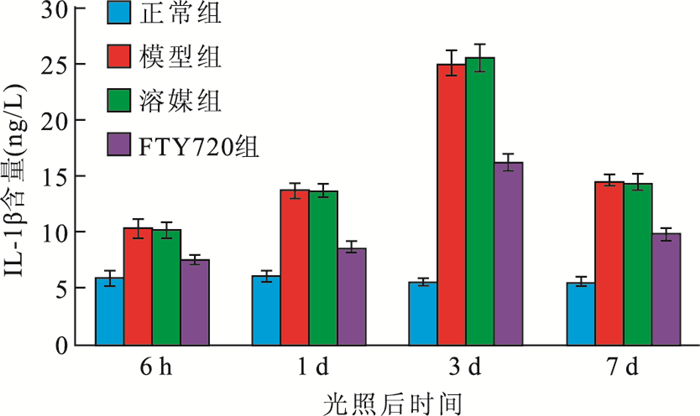 圖2
光照后不同時間點各組大鼠視網膜中IL-1β含量比較
圖2
光照后不同時間點各組大鼠視網膜中IL-1β含量比較
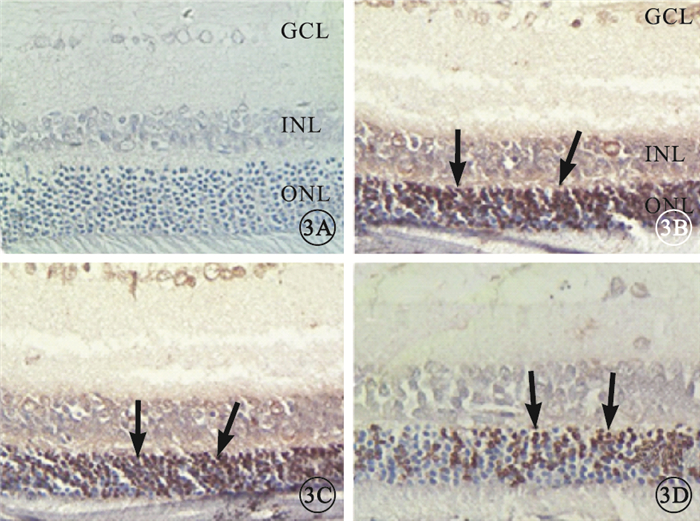
光照后1 d,正常組大鼠視網膜未見凋亡細胞,模型組、溶酶組大鼠視網膜可見大量凋亡細胞,FTY720組大鼠視網膜可見少量凋亡細胞(圖 3)。正常組、模型組、溶酶組及FTY720組大鼠視網膜凋亡細胞比例分別為0、(87.66±2.50)%、(86.00±2.44)%、(49.66±2.80)%。與正常組比較,模型組、溶酶組、FTY720組大鼠視網膜凋亡細胞比例明顯增加,差異有統計學意義(P<0.01)。模型組、溶酶組大鼠視網膜凋亡細胞比例比較,差異無統計學意義(P=0.21)。與模型組、溶酶組比較,FTY720組大鼠視網膜凋亡細胞比例明顯下降,差異均有統計學意義(F=2018,P<0.01)。
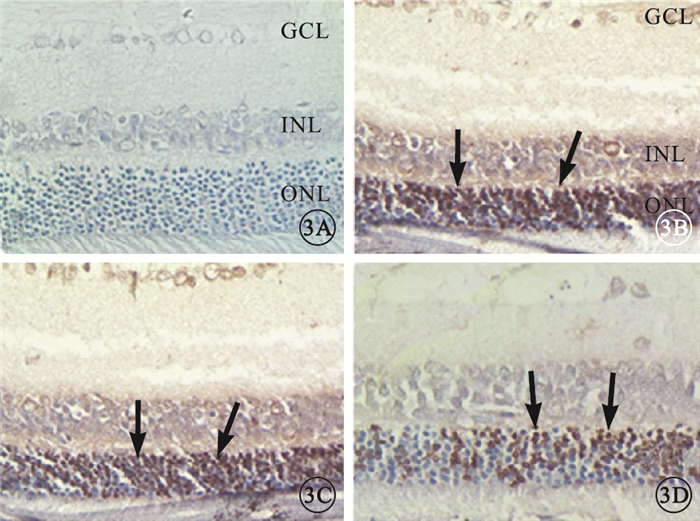 圖3
光照后1 d大鼠視網膜TUNEL染色像。3A.正常組,視網膜各層均未見凋亡細胞;3B.模型組,視網膜ONL可見大量凋亡細胞(黑箭);3C.溶媒組,視網膜ONL可見大量凋亡細胞(黑箭);3D. FTY720組,視網膜ONL可見少量凋亡細胞(黑箭) TUNEL×400
圖3
光照后1 d大鼠視網膜TUNEL染色像。3A.正常組,視網膜各層均未見凋亡細胞;3B.模型組,視網膜ONL可見大量凋亡細胞(黑箭);3C.溶媒組,視網膜ONL可見大量凋亡細胞(黑箭);3D. FTY720組,視網膜ONL可見少量凋亡細胞(黑箭) TUNEL×400
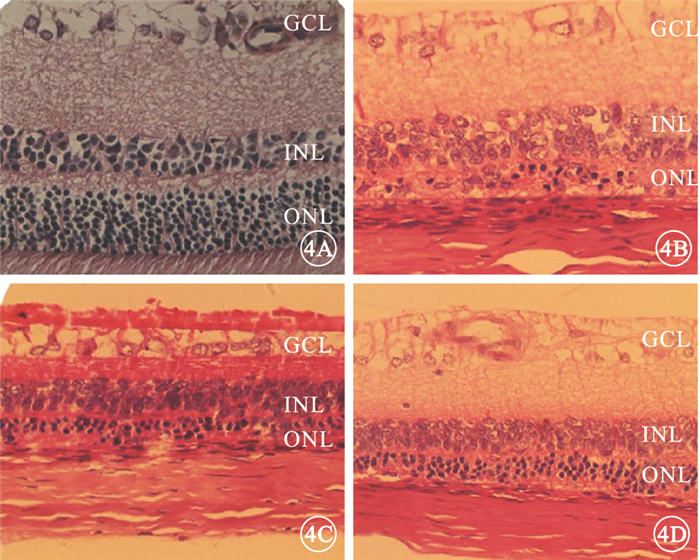
光照后7 d,光學顯微鏡觀察發現,正常組大鼠視網膜結構清晰,細胞排列整齊;溶酶組、模型組大鼠視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;FTY720組大鼠視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組(圖 4)。
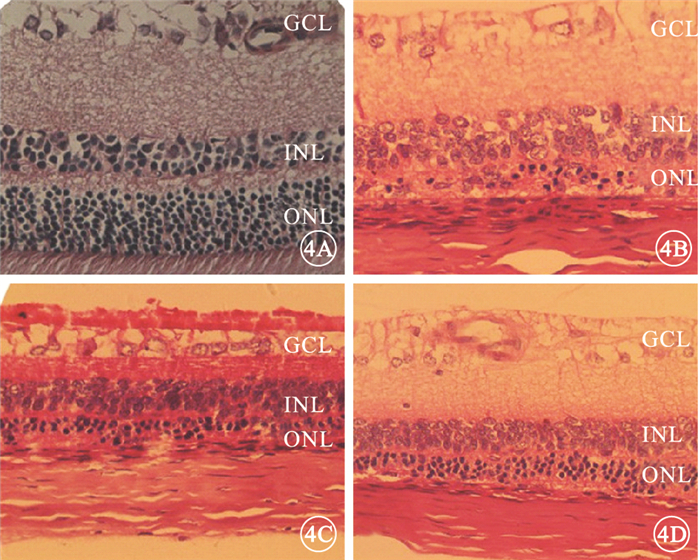 圖4
光照后7 d大鼠視網膜HE染色像。4A.正常組,視網膜結構清晰,細胞排列整齊;4B.模型組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4C.溶媒組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4D. FTY720組,視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組HE×400
圖4
光照后7 d大鼠視網膜HE染色像。4A.正常組,視網膜結構清晰,細胞排列整齊;4B.模型組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4C.溶媒組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4D. FTY720組,視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組HE×400
3 討論
FTY720是由冬蟲夏草中提取出來的抗生素成分多球囊菌素經化學修飾而成。作為新型免疫抑制劑,其毒副作用少、效果明顯,在多種疾病模型中都顯示出強大的免疫抑制效果。新近研究結果表明,FTY720除了強大的免疫抑制效應外,還對丙型肝炎病毒、腸道起搏器細胞及大麻素CB1受體等具有抑制和拮抗作用[7-9]。
一般認為視網膜光損傷分為兩大類:一種是長時間、中低強度的白光照射產生光感受器細胞的損傷,另一種是短時間、高強度的光照射產生視網膜色素上皮細胞的損傷。本研究主要觀察光源照射對光感受器細胞的損傷,因此采用第一種造模方式。盡管目前視網膜光損傷的研究頗多,但仍然沒有公認的光損傷動物模型的建立方法。不同研究使用的光照強度及光照時間均有所不同[10, 11]。本研究采用的強度為2700 Lux的白光照射6 h建立視網膜光損傷動物模型的方法在實驗研究中被廣泛應用,造模成功率高[12]。并且我們前期的預實驗結果也證實該建模方法可靠。
有研究表明,光照后1 d光感受器細胞凋亡達到高峰;而小膠質細胞在光照后6 h開始活化,3 d達到高峰,7 d開始下降[13]。因此,本研究選擇光照后1 d檢測光感受器細胞的凋亡情況,分別在光照后6 h及1、3、7 d對小膠質細胞所占比例和IL-1β含量進行檢測。多個研究表明,小膠質細胞在視網膜變性中大量活化,受刺激活化的小膠質細胞一方面會遷移至損傷部位清除壞死物質,一方面會分泌神經毒性細胞因子導致病變的進一步損傷[14, 15]。并且,在光損傷中使用小膠質細胞抑制劑降低其活化,同時也明顯降低了光感受器細胞的凋亡,并且在時間點上與其對小膠質細胞活化的抑制相一致[16]。我們通過對凋亡細胞的檢測以及組織學的觀察,發現FTY720能有效地減少光感受器細胞發生凋亡。鑒于FTY720在多發性硬化中對小膠質細胞的抑制作用以及小膠質細胞在光損傷中的重要作用,我們推測可能是因為FTY720抑制了小膠質細胞的活化,從而減少了光感受器細胞的凋亡。因此我們繼續檢測了光照后各個時間點小膠質細胞的表達情況。為了證實FTY720是通過抑制小膠質細胞起作用,我們同時也檢測了相同時間點炎癥因子IL-1β的表達情況。IL-1β是一種膠質源性炎癥因子和促凋亡因子。在多種小膠質細胞介導的神經變性疾病中,IL-1β隨小膠質細胞的增多而增多[17, 18]。我們發現,在各個時間點伴隨著小膠質細胞被抑制,IL-1β含量也發生變化,同樣受到抑制。由此我們推測,FTY720在光損傷后抑制了小膠質細胞的活化以及由此而產生的神經毒性因子,從而對小膠質細胞引起的光感受器細胞的繼發性損害進行了有效的保護。
本研究結果揭示了FTY720與視網膜光損傷后小膠質細胞的關系。這為我們進一步研究FTY720在眼科疾病中新的藥理作用以及小膠質細胞在視網膜光損傷中的更多功能做了鋪墊。但值得注意的是,我們未在本實驗研究中發現FTY720明顯的毒副作用,這是否與觀察時間較短有關還有待今后的研究繼續關注。
芬戈莫德(FTY720)是一種新型的免疫抑制劑,在多種自身免疫疾病、器官移植等疾病模型中均顯示出良好的免疫抑制效果[1, 2]。除了強大的免疫抑制效應外,FTY720還存在著其他的非免疫抑制效應[3, 4]。有研究發現,FTY720在多發性硬化動物模型中,能夠起到抑制小膠質細胞活化的作用,并且減少小膠質細胞產生的炎癥因子[5]。而小膠質細胞在視網膜光損傷中大量活化并遷移,在光損傷過程中發揮重要作用[6]。但目前就FTY720在視網膜光損傷中的作用研究還不太多,為了探討FTY720是否對視網膜光損傷后光感受器細胞具有保護作用及其可能的作用機制,我們觀察了FTY720對視網膜光損傷后凋亡細胞的抑制作用及其對小膠質細胞的影響。現將結果報道如下。
1 材料和方法
Sprague-Dawley大鼠120只,雌雄各半,6~8周齡,體重250~300 g,四川省人民醫院實驗動物研究所提供。原位末端標記(TUNEL)試劑盒(瑞士Roche公司),小膠質細胞流式Iba-1-異硫氰酸熒光素(FITC)抗體及同型對照抗體(美國Abcom公司),磷酸鹽緩沖液(PBS,美國Thermo公司),酶聯免疫吸附試驗(ELISA)試劑盒(美國RG公司),新生牛血清(美國Gibco公司)。流式細胞儀(美國Beckman公司)。
將大鼠隨機分為正常組、模型組、溶媒組和FTY720組,每組30只。正常組大鼠不予處理;模型組、溶媒組和FTY720組大鼠建立光損傷動物模型。模型組大鼠僅接受光照。FTY720組大鼠建模前0.5 h以10 mg/kg的劑量腹腔注射FTY720,溶媒組大鼠注射50%二甲基亞砜。自制大小140 cm×57 cm×119 cm的木箱,側面留通風孔;頂部安裝3根可調節亮度的白色熒光燈管,其余各面貼閃光紙,使木箱中光照均勻;調節光照強度為(2700±100)Lux,溫度控制在20~30℃。模型組、溶媒組和FTY720組大鼠出生后即在微弱循環光(5 Lux明適應12 h及暗適應12 h)環境下飼養至6~8周大小。光照前暗適應12 h后放入光損傷箱內接受白光照射6 h,在光照3 h時兩側均互相調換位置。光照結束后放回原飼養環境中喂養。
光照后6 h及1、3、7 d,斷頸處死各組大鼠,分離視網膜,剪碎,過200目不銹鋼濾網,收集濾液,離心,獲得單細胞懸液。將密度分別為1.030、1.072、1.088、1.123 g/ml的Percoll細胞分離液依次添加在細胞懸液上,離心吸取1.072、1.088 g/ml兩層細胞懸液,加Iba-1-FITC抗體孵育后應用流式細胞儀檢測視網膜中小膠質細胞所占比例。
光照后6 h及1、3、7 d,斷頸處死各組大鼠,分離視網膜,制成勻漿,將標本保存在液氮中,待標本采集完成后,按照ELISA試劑盒操作說明書檢測大鼠視網膜中白細胞介素(IL)-1β的含量。
光照后1 d,斷頸處死各組大鼠,摘取眼球,在12點鐘方向結膜連接視盤處做標記。常規固定、脫水、石蠟包埋、切片,按照TUNEL試劑盒進行染色,以棕黃色染色細胞為凋亡細胞。光學顯微鏡下采集圖片,計數凋亡細胞。
光照后7 d,斷頸處死各組大鼠,摘取眼球,在12點鐘方向結膜連接視盤處做標記。常規固定、脫水、石蠟包埋、切片,行蘇木精-伊紅(HE)染色,光學顯微鏡下觀察大鼠視網膜神經節細胞層(GCL)、內核層(INL)、外核層(ONL)等各層次形態結構。
采用SPSS 17.0軟件進行統計學分析。計量資料均以均數±標準差(
2 結果
流式細胞儀檢測結果顯示,大鼠視網膜中小膠質細胞所占比例于光照后6 h開始升高,光照后3 d達高峰,光照后7 d開始下降。正常組、模型組、溶酶組及FTY720組大鼠視網膜中小膠質細胞所占比例分別為24.40%、80.00%、74.40%、51.30%。光照后6 h及1、3、7 d,FTY720組大鼠視網膜中小膠質細胞所占比例均較模型組、溶酶組降低,較正常組升高,差異均有統計學意義(F=53、134、240、185,P<0.01)(圖 1)。
 圖1
光照后不同時間點各組大鼠視網膜中小膠質細胞所占比例比較
圖1
光照后不同時間點各組大鼠視網膜中小膠質細胞所占比例比較
ELISA檢測結果顯示,光照后大鼠視網膜中IL-1β含量的變化趨勢與小膠質細胞所占比例變化趨勢一致。光照后6 h及1、3、7 d,FTY720組大鼠視網膜中IL-1β含量均較模型組、溶酶組降低,較正常組升高,差異均有統計學意義(F=53、275、581、429,P<0.01)(圖 2)。
 圖2
光照后不同時間點各組大鼠視網膜中IL-1β含量比較
圖2
光照后不同時間點各組大鼠視網膜中IL-1β含量比較
光照后1 d,正常組大鼠視網膜未見凋亡細胞,模型組、溶酶組大鼠視網膜可見大量凋亡細胞,FTY720組大鼠視網膜可見少量凋亡細胞(圖 3)。正常組、模型組、溶酶組及FTY720組大鼠視網膜凋亡細胞比例分別為0、(87.66±2.50)%、(86.00±2.44)%、(49.66±2.80)%。與正常組比較,模型組、溶酶組、FTY720組大鼠視網膜凋亡細胞比例明顯增加,差異有統計學意義(P<0.01)。模型組、溶酶組大鼠視網膜凋亡細胞比例比較,差異無統計學意義(P=0.21)。與模型組、溶酶組比較,FTY720組大鼠視網膜凋亡細胞比例明顯下降,差異均有統計學意義(F=2018,P<0.01)。
 圖3
光照后1 d大鼠視網膜TUNEL染色像。3A.正常組,視網膜各層均未見凋亡細胞;3B.模型組,視網膜ONL可見大量凋亡細胞(黑箭);3C.溶媒組,視網膜ONL可見大量凋亡細胞(黑箭);3D. FTY720組,視網膜ONL可見少量凋亡細胞(黑箭) TUNEL×400
圖3
光照后1 d大鼠視網膜TUNEL染色像。3A.正常組,視網膜各層均未見凋亡細胞;3B.模型組,視網膜ONL可見大量凋亡細胞(黑箭);3C.溶媒組,視網膜ONL可見大量凋亡細胞(黑箭);3D. FTY720組,視網膜ONL可見少量凋亡細胞(黑箭) TUNEL×400
光照后7 d,光學顯微鏡觀察發現,正常組大鼠視網膜結構清晰,細胞排列整齊;溶酶組、模型組大鼠視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;FTY720組大鼠視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組(圖 4)。
 圖4
光照后7 d大鼠視網膜HE染色像。4A.正常組,視網膜結構清晰,細胞排列整齊;4B.模型組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4C.溶媒組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4D. FTY720組,視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組HE×400
圖4
光照后7 d大鼠視網膜HE染色像。4A.正常組,視網膜結構清晰,細胞排列整齊;4B.模型組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4C.溶媒組,視網膜結構不清楚,細胞排列紊亂,ONL明顯變薄;4D. FTY720組,視網膜結構清晰,ONL厚度較溶酶組、模型組厚,但薄于正常組HE×400
3 討論
FTY720是由冬蟲夏草中提取出來的抗生素成分多球囊菌素經化學修飾而成。作為新型免疫抑制劑,其毒副作用少、效果明顯,在多種疾病模型中都顯示出強大的免疫抑制效果。新近研究結果表明,FTY720除了強大的免疫抑制效應外,還對丙型肝炎病毒、腸道起搏器細胞及大麻素CB1受體等具有抑制和拮抗作用[7-9]。
一般認為視網膜光損傷分為兩大類:一種是長時間、中低強度的白光照射產生光感受器細胞的損傷,另一種是短時間、高強度的光照射產生視網膜色素上皮細胞的損傷。本研究主要觀察光源照射對光感受器細胞的損傷,因此采用第一種造模方式。盡管目前視網膜光損傷的研究頗多,但仍然沒有公認的光損傷動物模型的建立方法。不同研究使用的光照強度及光照時間均有所不同[10, 11]。本研究采用的強度為2700 Lux的白光照射6 h建立視網膜光損傷動物模型的方法在實驗研究中被廣泛應用,造模成功率高[12]。并且我們前期的預實驗結果也證實該建模方法可靠。
有研究表明,光照后1 d光感受器細胞凋亡達到高峰;而小膠質細胞在光照后6 h開始活化,3 d達到高峰,7 d開始下降[13]。因此,本研究選擇光照后1 d檢測光感受器細胞的凋亡情況,分別在光照后6 h及1、3、7 d對小膠質細胞所占比例和IL-1β含量進行檢測。多個研究表明,小膠質細胞在視網膜變性中大量活化,受刺激活化的小膠質細胞一方面會遷移至損傷部位清除壞死物質,一方面會分泌神經毒性細胞因子導致病變的進一步損傷[14, 15]。并且,在光損傷中使用小膠質細胞抑制劑降低其活化,同時也明顯降低了光感受器細胞的凋亡,并且在時間點上與其對小膠質細胞活化的抑制相一致[16]。我們通過對凋亡細胞的檢測以及組織學的觀察,發現FTY720能有效地減少光感受器細胞發生凋亡。鑒于FTY720在多發性硬化中對小膠質細胞的抑制作用以及小膠質細胞在光損傷中的重要作用,我們推測可能是因為FTY720抑制了小膠質細胞的活化,從而減少了光感受器細胞的凋亡。因此我們繼續檢測了光照后各個時間點小膠質細胞的表達情況。為了證實FTY720是通過抑制小膠質細胞起作用,我們同時也檢測了相同時間點炎癥因子IL-1β的表達情況。IL-1β是一種膠質源性炎癥因子和促凋亡因子。在多種小膠質細胞介導的神經變性疾病中,IL-1β隨小膠質細胞的增多而增多[17, 18]。我們發現,在各個時間點伴隨著小膠質細胞被抑制,IL-1β含量也發生變化,同樣受到抑制。由此我們推測,FTY720在光損傷后抑制了小膠質細胞的活化以及由此而產生的神經毒性因子,從而對小膠質細胞引起的光感受器細胞的繼發性損害進行了有效的保護。
本研究結果揭示了FTY720與視網膜光損傷后小膠質細胞的關系。這為我們進一步研究FTY720在眼科疾病中新的藥理作用以及小膠質細胞在視網膜光損傷中的更多功能做了鋪墊。但值得注意的是,我們未在本實驗研究中發現FTY720明顯的毒副作用,這是否與觀察時間較短有關還有待今后的研究繼續關注。