引用本文: 王友, 鄧鉑林, 黃健, 安剛. 玻璃體腔注射雷珠單抗治療嚴重增生型糖尿病視網膜病變后玻璃體細胞因子的變化. 中華眼底病雜志, 2014, 30(5): 484-487. doi: 10.3760/cma.j.issn.1005-1015.2014.05.014 復制
增生型糖尿病視網膜病變(PDR)的新生血管可發生于視盤(NVD)、視網膜(NVE)、虹膜(NVI)和前房角(NVA),血管內皮生長因子(VEGF)在其發生發展病理過程中扮演著重要的角色。近年來研究發現,玻璃體腔注射抗VEGF藥物聯合玻璃體切割手術治療嚴重PDR可取得較好療效[1-5]。然而,玻璃體腔注射抗VEGF藥物后,盡管下調了VEGF水平,但可能會引起眼球內其他炎性因子的改變[6]。為了觀察玻璃體注射抗VEGF藥物后玻璃體內相關炎性因子的具體表達情況,我們對一組行玻璃體腔注射雷珠單抗聯合玻璃體切割手術治療的PDR患者的玻璃體炎性細胞因子VEGF、白介素(IL)-6、IL-8、細胞間黏附分子-1(ICAM-1)和結締組織生長因子(CTGF)濃度進行了測定,現將結果報道如下。
1 對象和方法
本研究為前瞻性、對照、非盲法臨床試驗。其研究經醫院倫理委員會討論通過;患者均獲知情并簽署同意書。患者臨床診斷、治療以及標本采集工作在錦州市中心醫院眼科完成。標本檢測在遼寧醫學院基礎醫學實驗室完成。
2012年2月1日至2013年11月1日臨床檢查確診的PDR患者80例80只眼納入研究。其中,男性43例,女性37例;年齡32~78歲,平均年齡(56.13±8.83)歲。均為單眼。所有患者均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、B型超聲、眼壓、光相干斷層掃描(OCT)、熒光素眼底血管造影(FFA)檢查。患者臨床表現和檢查結果符合PDR國際臨床診斷標準[7],嚴重PDR定義為存在活動性新生血管和纖維增生[8],滿足以下條件之一,存在NVD或范圍≥1個視盤直徑(DD)的NVE、NVI、NVD,同時伴或不伴有視網膜脫離的纖維增生[9]。納入標準:(1)2型糖尿病,藥物控制空腹血糖≤7.8 mmol/L,時間≥1個月。(2)眼底或眼前節改變滿足以下條件之一,累及中心凹的黃斑前出血≥1 DD,中心凹外黃斑區前出血≥2 DD,后極部視網膜前出血≥3 DD;機化膜≥3條合并牽拉性視網膜脫離累及黃斑或范圍≥4 DD,時間≤3個月; NVI;NVA。(3)BCVA光感~0.2。(4)計劃行玻璃體切割手術治療者。排除標準:(1)伴有視網膜中央或分支動脈阻塞、高度近視、異狀胬肉、青光眼、角膜疾病、葡萄膜炎者。(2)晶狀體混濁≥Ⅳ級。(3)6個月內有糖皮質激素治療史,全視網膜激光光凝(PRP)或玻璃體切割手術治療史。(4)玻璃體切割手術中發現玻璃體積血非PDR引起者。(5)HbA1c<6.8 %或≥16.0%。(6)高血壓及其他心血管疾病或免疫性疾病如系統性紅斑狼瘡、Behet病、強制性脊柱炎等。(7)全身疾病和身體狀態不能耐受手術者。
依照非主動隨機方法將80例80只眼分為單純玻璃體切割手術組(A組)、玻璃體腔注射雷珠單抗聯合玻璃體切割手術組(B組),均為40例40只眼。A組40例中,男性22例,占55.0%;女性18例,占45.0%。年齡32~78歲,平均年齡(56.93±9.77)歲;糖尿病病程8~30年,平均病程(17.43±4.92)年;HbA1c 6.8%~15.2%,平均HbA1c(9.58±1.94)%;6個月前有PRP治療史12只眼,占30.0%;平均眼壓(17.32± 3.50) mmHg(1 mmHg=0.133 kPa)。玻璃體積血9例,牽拉性視網膜脫離19例,視網膜前出血12例。B組40例中,男性21例,占52.5%;女性19例,占47.5%。年齡39~69歲,平均年齡(55.50±7.17)歲;糖尿病病程9~28年,平均病程(16.70±4.74)年;HbA1c 7.5%~14.6%,平均HbA1c(9.95±2.05)%;玻璃體腔注射雷珠單抗前平均眼壓(17.48±3.05) mmHg,玻璃體切割手術前平均眼壓(16.2±3.14) mmHg。玻璃體積血7例,牽拉性視網膜脫離23例,視網膜前出血10例。兩組間性別(χ2=0.05)、年齡(t=0.59)、糖尿病病程(t=0.36)、HbA1c(t=0.13)比較,差異無統計學意義(P>0.05)。兩組間并發癥比較,差異無統計學意義(χ2=0.31、1.33、0.25,P>0.05)。兩組均無單純NVI或NVA患者。A組平均眼壓,B組注藥前、玻璃體切割手術前平均眼壓比較,差異無統計學意義(F=0.81,P>0.05)。
A組患眼行玻璃體切割手術前抽取玻璃體液0.4 ml。 B組患眼行玻璃體切割手術前7 d,玻璃體腔注射雷珠單抗0.05 ml (含雷珠單抗0.5 mg),因倫理原因未抽取玻璃體液或房水;注藥后7d行玻璃體切割手術前抽取玻璃體液0.4 ml;存在牽拉性視網膜脫離者行玻璃體切割硅油填充手術。注藥及玻璃體切割手術為同一有經驗醫師完成。
采用雙抗體酶聯免疫吸附試驗(ELISA)法測定玻璃體VEGF、IL-6、IL-8、ICAM-1、CTGF濃度。試劑盒均購自北京博凌科為生物公司(進口分裝美國R&D公司產品),靈敏度VEGF、IL-6、IL-8、ICAM-1、CTGF分別為3.70、4.75、2.50、5.75、2.50 pg/L。酶聯免疫分析采用Organon Teknia R eader 530分析儀,嚴格按說明書操作;繪制標準曲線,計算樣本VEGF、IL-6、IL-8、ICAM-1、CTGF濃度。
SPSS17.0統計軟件行統計學分析處理。A組手術前,B組注藥前、手術前眼壓比較行方差分析;兩組VEGF、IL-6、IL-8、ICAM-1、CTGF濃度比較,結果以均數±標準差(
2 結果
A、B組VEGF、IL-6、IL-8、ICAM-1、CTGF濃度比較,B組VEGF、ICAM-1濃度明顯低于A組,差異有統計學意義(t=16.34、12.53,P<0.001);IL-6、 IL-8濃度高于A組,差異有統計學意義(t=11.97、12.24,P<0.001);CTGF濃度較A組略升高,差異無統計學意義(t=1.39,P>0.05)(圖 1);CTGF/VEGF較A組升高,差異有統計學意義(t=14.75,P<0.001)。
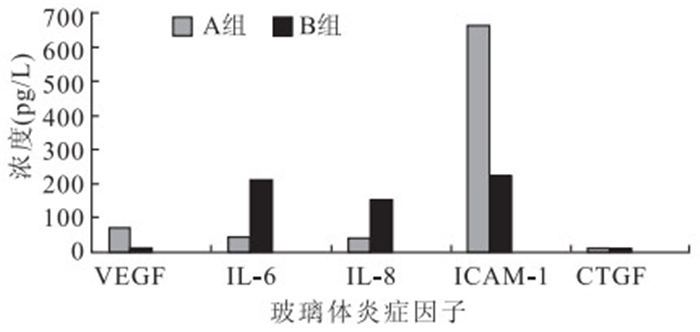 圖1
兩組玻璃體各炎癥因子濃度比較
圖1
兩組玻璃體各炎癥因子濃度比較
相關性分析結果顯示,VEGF與IL-6、IL-8成負相關,相關性較高;與ICAM-1成正相關;與CTGF相關性低(表 1)。
3 討論
本研究嚴格按照納入及排除標準選擇納入觀察患者,非主動隨機分為兩組,兩組間患者一般情況無差異。A組在玻璃體手術前,B組在給予玻璃體腔注射雷珠單抗7 d后玻璃體手術前抽取玻璃體液并測量其VEGF及其它因子濃度,比較兩組間差異是否具有統計學意義。實驗過程簡單,數據可靠。
炎性細胞因子在糖尿病視網膜病變(DR)中的具體作用機制雖然迄今仍然不完全清楚,但其重要性毋庸置疑。VEGF所導致的血管通透性增加與新生血管形成是致DR發展的一個重要原因[10],而在VEGF的產生以及損害血管內皮細胞、增加通透性的過程中,IL是一個重要的參與因子[11],且VEGF誘導ICAM-1表達,使DR早期白細胞黏附于血管內皮,啟動整個病理過程[12]。本研究中,玻璃體腔注射雷珠單抗7 d后,B組玻璃體中VEGF濃度明顯低于A組,提示PDR患者在注射雷珠單抗7 d后玻璃體中VEGF的濃度明顯下降,結果與文獻報道一致[6],這也是抗VEGF藥物治療DR的基礎[13]。而隨著VEGF濃度下降,新生血管退化,可以降低嚴重PDR玻璃體切割除手術的難度[14]。
IL-6是在缺血缺氧的視網膜環境下,由血管內皮細胞或者血管平滑肌細胞合成與分泌的多功能因子[15],它在機體免疫調制過程和急性反應過程中起重要的作用,而且它也有引導VEGF分泌的作用[16]。IL-8是一種CXC趨化因子,它被認為是一個中性粒細胞和T淋巴細胞的強效趨化因子激活劑[17],有促進血管生成和腫瘤轉移的作用[18]。Jeon和Lee[19]在其研 究中發現,玻璃體腔注射貝伐單抗后第1天,IL-6、IL-8 濃度明顯高于治療前及治療后第7天,但第1天與第7天IL-8的濃度變化差異并沒有統計學意義,他們認為IL-6的急性升高是眼內視網膜缺血缺氧的共同反應途徑,視網膜組織低灌注下IL-6及VEGF等相關因子的代償性升高,可改善眼底供血,是缺血所導致的調節結果而并非缺血所致并發癥。而Petrovi?等[20]認為玻璃體切割手術后IL-8的升高可能是視網膜缺血及急性反應所致。本研究中,B組IL-6、IL-8較A組明顯升高,說明玻璃體腔注射雷珠單抗7 d后玻璃體液中IL-6、IL-8濃度升高。雖然二者的升高與VEGF值相關度較高,但并不能直接說明是VEGF的降低所導致,也可能是注射時穿刺或藥物作用過程中的急性反應,或視網膜缺血缺氧所導致的調節結果,其具體機制仍需要進一步研究。
ICAM-1又名CD54,通常是由內皮細胞或者免疫細胞所釋放的細胞表面糖蛋白。DR發展的一個重要初始步驟是白細胞黏附和損傷血管內皮細胞,而最早的損害是由ICAM-1和白細胞整合CD18介導的。ICAM -1通過與不同的細胞因子包括IL-1、腫瘤壞死因子-α、干擾素-γ的相互作用參與免疫激活炎癥反應[11, 22]。已有研究證實,PDR患者中ICAM-1通常呈 現高表達,且與血漿HbA1c正相關[23, 24]。Hinton等[25] 認為ICAM-1的濃度與PDR患者黃斑水腫密切相關,是最重要的一個炎性細胞因子。本研究中,B組ICAM-1的濃度明顯低于A組,而VEGF的濃度與ICAM-1濃度相關性較高,說明隨著玻璃體VEGF濃度的降低,內皮細胞及免疫細胞釋放ICAM-1的量明顯減少,具體機制尚不清楚。
CTGF在纖維化過程中起著重要作用,它在增生性玻璃體視網膜病變、脈絡膜新生血管、PDR中表達均高于正常眼[26]。有研究認為,VEGF會增加CTGF的表達,注射貝伐單抗后可以加速PDR纖維化,引起牽拉性視網膜脫離[27, 28]。Kuiper等[29]的研究也證實VEGF/CTGF在PDR中血管化與纖維化的作用。本研究結果顯示,A、B組CTGF濃度差異并無統計學意義,但CTGF/VEGF差異有統計學意義,它的升高可能是導致纖維增生的一個原因。目前文獻報道CTGF升高多來自于貝伐單抗,而雷珠單抗治療PDR的研究資料尚少,本文研究進行了初步探討,而更精確的資料需要進一步實驗。
本研究為前瞻性、對照、非盲法試驗。分組為非主動隨機,雖然希望能夠有一個隨機化的過程,但鑒于倫理等原因未采用,可能會產生選擇偏倚。我們考慮患者在自主選擇治療方式的時候,經濟條件仍然是其主要原因,為盡量減少選擇偏倚,所有患者均嚴格按納入標準選擇,所得結果準確可靠。
增生型糖尿病視網膜病變(PDR)的新生血管可發生于視盤(NVD)、視網膜(NVE)、虹膜(NVI)和前房角(NVA),血管內皮生長因子(VEGF)在其發生發展病理過程中扮演著重要的角色。近年來研究發現,玻璃體腔注射抗VEGF藥物聯合玻璃體切割手術治療嚴重PDR可取得較好療效[1-5]。然而,玻璃體腔注射抗VEGF藥物后,盡管下調了VEGF水平,但可能會引起眼球內其他炎性因子的改變[6]。為了觀察玻璃體注射抗VEGF藥物后玻璃體內相關炎性因子的具體表達情況,我們對一組行玻璃體腔注射雷珠單抗聯合玻璃體切割手術治療的PDR患者的玻璃體炎性細胞因子VEGF、白介素(IL)-6、IL-8、細胞間黏附分子-1(ICAM-1)和結締組織生長因子(CTGF)濃度進行了測定,現將結果報道如下。
1 對象和方法
本研究為前瞻性、對照、非盲法臨床試驗。其研究經醫院倫理委員會討論通過;患者均獲知情并簽署同意書。患者臨床診斷、治療以及標本采集工作在錦州市中心醫院眼科完成。標本檢測在遼寧醫學院基礎醫學實驗室完成。
2012年2月1日至2013年11月1日臨床檢查確診的PDR患者80例80只眼納入研究。其中,男性43例,女性37例;年齡32~78歲,平均年齡(56.13±8.83)歲。均為單眼。所有患者均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、間接檢眼鏡、B型超聲、眼壓、光相干斷層掃描(OCT)、熒光素眼底血管造影(FFA)檢查。患者臨床表現和檢查結果符合PDR國際臨床診斷標準[7],嚴重PDR定義為存在活動性新生血管和纖維增生[8],滿足以下條件之一,存在NVD或范圍≥1個視盤直徑(DD)的NVE、NVI、NVD,同時伴或不伴有視網膜脫離的纖維增生[9]。納入標準:(1)2型糖尿病,藥物控制空腹血糖≤7.8 mmol/L,時間≥1個月。(2)眼底或眼前節改變滿足以下條件之一,累及中心凹的黃斑前出血≥1 DD,中心凹外黃斑區前出血≥2 DD,后極部視網膜前出血≥3 DD;機化膜≥3條合并牽拉性視網膜脫離累及黃斑或范圍≥4 DD,時間≤3個月; NVI;NVA。(3)BCVA光感~0.2。(4)計劃行玻璃體切割手術治療者。排除標準:(1)伴有視網膜中央或分支動脈阻塞、高度近視、異狀胬肉、青光眼、角膜疾病、葡萄膜炎者。(2)晶狀體混濁≥Ⅳ級。(3)6個月內有糖皮質激素治療史,全視網膜激光光凝(PRP)或玻璃體切割手術治療史。(4)玻璃體切割手術中發現玻璃體積血非PDR引起者。(5)HbA1c<6.8 %或≥16.0%。(6)高血壓及其他心血管疾病或免疫性疾病如系統性紅斑狼瘡、Behet病、強制性脊柱炎等。(7)全身疾病和身體狀態不能耐受手術者。
依照非主動隨機方法將80例80只眼分為單純玻璃體切割手術組(A組)、玻璃體腔注射雷珠單抗聯合玻璃體切割手術組(B組),均為40例40只眼。A組40例中,男性22例,占55.0%;女性18例,占45.0%。年齡32~78歲,平均年齡(56.93±9.77)歲;糖尿病病程8~30年,平均病程(17.43±4.92)年;HbA1c 6.8%~15.2%,平均HbA1c(9.58±1.94)%;6個月前有PRP治療史12只眼,占30.0%;平均眼壓(17.32± 3.50) mmHg(1 mmHg=0.133 kPa)。玻璃體積血9例,牽拉性視網膜脫離19例,視網膜前出血12例。B組40例中,男性21例,占52.5%;女性19例,占47.5%。年齡39~69歲,平均年齡(55.50±7.17)歲;糖尿病病程9~28年,平均病程(16.70±4.74)年;HbA1c 7.5%~14.6%,平均HbA1c(9.95±2.05)%;玻璃體腔注射雷珠單抗前平均眼壓(17.48±3.05) mmHg,玻璃體切割手術前平均眼壓(16.2±3.14) mmHg。玻璃體積血7例,牽拉性視網膜脫離23例,視網膜前出血10例。兩組間性別(χ2=0.05)、年齡(t=0.59)、糖尿病病程(t=0.36)、HbA1c(t=0.13)比較,差異無統計學意義(P>0.05)。兩組間并發癥比較,差異無統計學意義(χ2=0.31、1.33、0.25,P>0.05)。兩組均無單純NVI或NVA患者。A組平均眼壓,B組注藥前、玻璃體切割手術前平均眼壓比較,差異無統計學意義(F=0.81,P>0.05)。
A組患眼行玻璃體切割手術前抽取玻璃體液0.4 ml。 B組患眼行玻璃體切割手術前7 d,玻璃體腔注射雷珠單抗0.05 ml (含雷珠單抗0.5 mg),因倫理原因未抽取玻璃體液或房水;注藥后7d行玻璃體切割手術前抽取玻璃體液0.4 ml;存在牽拉性視網膜脫離者行玻璃體切割硅油填充手術。注藥及玻璃體切割手術為同一有經驗醫師完成。
采用雙抗體酶聯免疫吸附試驗(ELISA)法測定玻璃體VEGF、IL-6、IL-8、ICAM-1、CTGF濃度。試劑盒均購自北京博凌科為生物公司(進口分裝美國R&D公司產品),靈敏度VEGF、IL-6、IL-8、ICAM-1、CTGF分別為3.70、4.75、2.50、5.75、2.50 pg/L。酶聯免疫分析采用Organon Teknia R eader 530分析儀,嚴格按說明書操作;繪制標準曲線,計算樣本VEGF、IL-6、IL-8、ICAM-1、CTGF濃度。
SPSS17.0統計軟件行統計學分析處理。A組手術前,B組注藥前、手術前眼壓比較行方差分析;兩組VEGF、IL-6、IL-8、ICAM-1、CTGF濃度比較,結果以均數±標準差(
2 結果
A、B組VEGF、IL-6、IL-8、ICAM-1、CTGF濃度比較,B組VEGF、ICAM-1濃度明顯低于A組,差異有統計學意義(t=16.34、12.53,P<0.001);IL-6、 IL-8濃度高于A組,差異有統計學意義(t=11.97、12.24,P<0.001);CTGF濃度較A組略升高,差異無統計學意義(t=1.39,P>0.05)(圖 1);CTGF/VEGF較A組升高,差異有統計學意義(t=14.75,P<0.001)。
 圖1
兩組玻璃體各炎癥因子濃度比較
圖1
兩組玻璃體各炎癥因子濃度比較
相關性分析結果顯示,VEGF與IL-6、IL-8成負相關,相關性較高;與ICAM-1成正相關;與CTGF相關性低(表 1)。
3 討論
本研究嚴格按照納入及排除標準選擇納入觀察患者,非主動隨機分為兩組,兩組間患者一般情況無差異。A組在玻璃體手術前,B組在給予玻璃體腔注射雷珠單抗7 d后玻璃體手術前抽取玻璃體液并測量其VEGF及其它因子濃度,比較兩組間差異是否具有統計學意義。實驗過程簡單,數據可靠。
炎性細胞因子在糖尿病視網膜病變(DR)中的具體作用機制雖然迄今仍然不完全清楚,但其重要性毋庸置疑。VEGF所導致的血管通透性增加與新生血管形成是致DR發展的一個重要原因[10],而在VEGF的產生以及損害血管內皮細胞、增加通透性的過程中,IL是一個重要的參與因子[11],且VEGF誘導ICAM-1表達,使DR早期白細胞黏附于血管內皮,啟動整個病理過程[12]。本研究中,玻璃體腔注射雷珠單抗7 d后,B組玻璃體中VEGF濃度明顯低于A組,提示PDR患者在注射雷珠單抗7 d后玻璃體中VEGF的濃度明顯下降,結果與文獻報道一致[6],這也是抗VEGF藥物治療DR的基礎[13]。而隨著VEGF濃度下降,新生血管退化,可以降低嚴重PDR玻璃體切割除手術的難度[14]。
IL-6是在缺血缺氧的視網膜環境下,由血管內皮細胞或者血管平滑肌細胞合成與分泌的多功能因子[15],它在機體免疫調制過程和急性反應過程中起重要的作用,而且它也有引導VEGF分泌的作用[16]。IL-8是一種CXC趨化因子,它被認為是一個中性粒細胞和T淋巴細胞的強效趨化因子激活劑[17],有促進血管生成和腫瘤轉移的作用[18]。Jeon和Lee[19]在其研 究中發現,玻璃體腔注射貝伐單抗后第1天,IL-6、IL-8 濃度明顯高于治療前及治療后第7天,但第1天與第7天IL-8的濃度變化差異并沒有統計學意義,他們認為IL-6的急性升高是眼內視網膜缺血缺氧的共同反應途徑,視網膜組織低灌注下IL-6及VEGF等相關因子的代償性升高,可改善眼底供血,是缺血所導致的調節結果而并非缺血所致并發癥。而Petrovi?等[20]認為玻璃體切割手術后IL-8的升高可能是視網膜缺血及急性反應所致。本研究中,B組IL-6、IL-8較A組明顯升高,說明玻璃體腔注射雷珠單抗7 d后玻璃體液中IL-6、IL-8濃度升高。雖然二者的升高與VEGF值相關度較高,但并不能直接說明是VEGF的降低所導致,也可能是注射時穿刺或藥物作用過程中的急性反應,或視網膜缺血缺氧所導致的調節結果,其具體機制仍需要進一步研究。
ICAM-1又名CD54,通常是由內皮細胞或者免疫細胞所釋放的細胞表面糖蛋白。DR發展的一個重要初始步驟是白細胞黏附和損傷血管內皮細胞,而最早的損害是由ICAM-1和白細胞整合CD18介導的。ICAM -1通過與不同的細胞因子包括IL-1、腫瘤壞死因子-α、干擾素-γ的相互作用參與免疫激活炎癥反應[11, 22]。已有研究證實,PDR患者中ICAM-1通常呈 現高表達,且與血漿HbA1c正相關[23, 24]。Hinton等[25] 認為ICAM-1的濃度與PDR患者黃斑水腫密切相關,是最重要的一個炎性細胞因子。本研究中,B組ICAM-1的濃度明顯低于A組,而VEGF的濃度與ICAM-1濃度相關性較高,說明隨著玻璃體VEGF濃度的降低,內皮細胞及免疫細胞釋放ICAM-1的量明顯減少,具體機制尚不清楚。
CTGF在纖維化過程中起著重要作用,它在增生性玻璃體視網膜病變、脈絡膜新生血管、PDR中表達均高于正常眼[26]。有研究認為,VEGF會增加CTGF的表達,注射貝伐單抗后可以加速PDR纖維化,引起牽拉性視網膜脫離[27, 28]。Kuiper等[29]的研究也證實VEGF/CTGF在PDR中血管化與纖維化的作用。本研究結果顯示,A、B組CTGF濃度差異并無統計學意義,但CTGF/VEGF差異有統計學意義,它的升高可能是導致纖維增生的一個原因。目前文獻報道CTGF升高多來自于貝伐單抗,而雷珠單抗治療PDR的研究資料尚少,本文研究進行了初步探討,而更精確的資料需要進一步實驗。
本研究為前瞻性、對照、非盲法試驗。分組為非主動隨機,雖然希望能夠有一個隨機化的過程,但鑒于倫理等原因未采用,可能會產生選擇偏倚。我們考慮患者在自主選擇治療方式的時候,經濟條件仍然是其主要原因,為盡量減少選擇偏倚,所有患者均嚴格按納入標準選擇,所得結果準確可靠。