基因改造動物模型可用于基因的功能學研究,傳統基因改造費時費力。規律成簇的間隔短回文重復序列/Cas內切酶基因編輯技術是一種新型的基因打靶技術,構建簡單、方便且成本較低,能在單個受精卵時期快速實現多個精確的靶基因突變,用于檢測基因組中的基因表達和相互作用,明確基因功能。目前該項技術雖處于研究的初步階段,穩定性方面尚無定論;但因高效的基因改造效率,使得該項技術具有較強的應用前景。通過建立合適的眼部疾病動物模型可以推動遺傳性視網膜疾病的基因功能學研究,為基因治療在眼科領域的開展打下基礎。
引用本文: 丁瑜芝, 胡仔仲, 袁松濤, 劉慶淮. 規律成簇的間隔短回文重復序列/Cas內切酶基因編輯技術及其在眼科研究進展. 中華眼底病雜志, 2016, 32(6): 654-657. doi: 10.3760/cma.j.issn.1005-1015-2016.06.026 復制
許多疾病的基因組學高度復雜,涉及到基因的位點突變,染色體異位、缺失或增多。為研究基因突變對疾病產生的影響,需要有精確的模型動物。傳統模型動物構建費時費力,步驟繁瑣,甚至需要操縱胚胎干細胞。同源重組技術是最早應用在哺乳動物細胞中的基因敲除方法,隨后逐漸發展了以Cre/LoxP系統為基礎的組織特異性基因敲除技術,并利用某些標記基因對Cre誘導表達,實現基因敲除的時間調控[1]。而后報道的可誘導區域性蛋白質敲除技術、鋅指酶(ZFNs)技術和轉錄激活因子樣效應物核酸酶(TALENs)技術已實現體內基因編輯,可使構建的模式動物在數分鐘激活或敲除特定蛋白質,極大提高了基因改造的效率[2, 3]。近年發現的規律成簇的間隔短回文重復序列(CRISPR)/Cas內切酶(CRISPR/Cas)基因編輯技術是一種新型的基因改造技術[4],由于能高效改造哺乳動物的基因組,在治療空間特異性強的基因突變導致的遺傳性疾病中,CRISPR/Cas基因編輯技術具有很強的應用前景[5]。現就CRISPR/Cas基因編輯技術工作原理及其在眼科的研究進展作一綜述。
1 CRISPR/Cas基因編輯技術工作原理
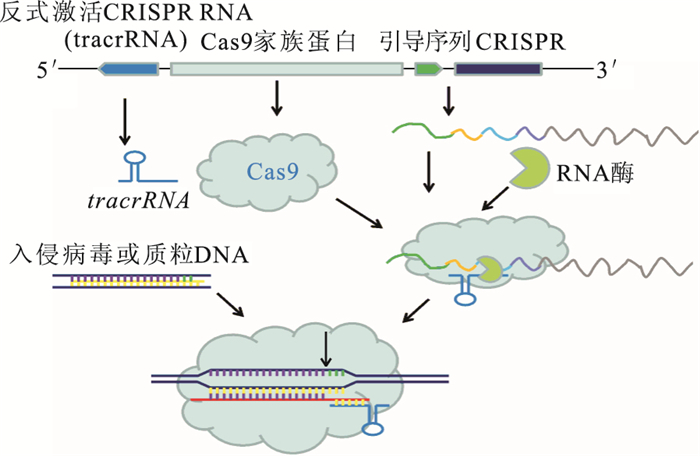
CRISPR/Cas最初在鏈球菌細胞內發現[6],作為一種抵抗病毒或者噬菌體的獲得性免疫防御分子,干擾是CRISPR/Cas發揮抵御外源遺傳物質入侵最關鍵的步驟。成熟的CRISPR RNA與特異的Cas蛋白形成核糖核蛋白復合物,能與外源DNA結合并掃描其靶序列,通過CRISPR RNA的間隔序列與靶序列互補配對,外源DNA在配對的特定位置被核糖核蛋白復合物切割。間隔序列由俘獲的外源DNA組成,記錄外源遺傳物質入侵順序,類似免疫記憶,當含有同樣序列的外源DNA入侵時,可被細菌機體識別,并進行剪切使之表達沉默,達到保護自身安全的目的[7, 8]。CRISPR/Cas系統有3種類型,其中2型系統在實現其核酸酶和內切酶功能時僅需要Cas9的Cas家族蛋白輔助。Cas9為核酸內切酶,利用一段可編碼的短引導RNA序列(sgRNA),可以識別保守的間隔相鄰基序,對DNA進行雙鏈剪切(圖 1)[9, 10]。被剪切的雙鏈通過兩種方式進行修復,一種是非同源末端連接,可引起目標基因無義突變或插入缺失突變;另一種是同源重組,應用同源性模板序列對靶向序列進行基因編輯或改正。
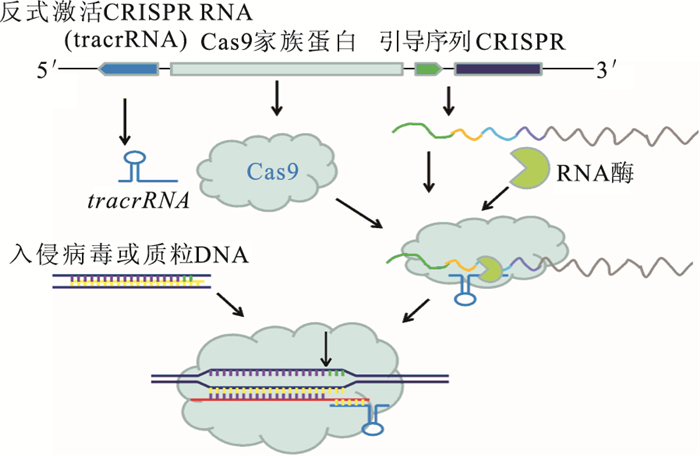 圖1
CRISPR/Cas9干擾外源DNA入侵示意圖
圖1
CRISPR/Cas9干擾外源DNA入侵示意圖
傳統的基因敲除技術需要經過幾代約6個月至1年甚至更長的時間才能獲得單鏈或雙鏈基因突變體,且隨著代數增高,其適用性不斷減弱。將多種不同sgRNA應用于同一CRISPR/Cas9系統即可對不同位點同時進行基因改造,實現高效,多通道基因編輯[4]。進行這種多位點CRISPR/Cas基因編輯技術改造,費用低,靈活、高效且特異性強,更方便在模型動物中大量研究某些特殊和罕見的基因突變。
2 CRISPR/Cas基因編輯技術在眼科的研究進展
由于CRISPR/Cas基因編輯技術的簡便和高效,目前在生物技術領域、基礎生物和醫學領域受到高度重視,已被應用于乙型肝炎、人類免疫缺陷病毒(HIV)、神經系統疾病和癌癥疾病模型動物中[11]。Ebina等[12]利用該技術將HIV-1啟動子沉默,在感染CRISPR/Cas9質粒的人干細胞細胞中發現HIV-1表達明顯下降。因此,可以利用CRISPR/Cas基因編輯技術對一些難以治愈的疾病進行基因修復,以恢復其正常功能。在眼科基礎研究中,CRISPR/Cas基因編輯技術首先應用于眼部視網膜基因敲除,運用電穿孔轉染視網膜細胞對基因進行改造。
2.1 CRISPR/Cas基因編輯技術在不同動物模型中的功能研究
在斑馬魚模型中,Ota等[13]利用CRISPR/Cas基因編輯技術敲除了斑馬魚胚胎中與視網膜色素上皮(RPE)色素生成相關基因gol和tyr,發現在F0代能有效產生低色素的表型,并將這種表型遺傳給后代。Chrispell等[14]也分別利用ZFNs、TALENs和CRISPR/Cas基因編輯技術對斑馬魚幼體進行基因改造。
小鼠模型中,Parikh等[15]對小鼠原核受精卵使用Cas9和sgRNA靶向絡氨酸基因敲除,除觀察小鼠毛發及眼的顏色改變外,還發現供體DNA片段如果沒有修飾,Cas9催化活性將被抑制而不啟動基因修復。這種基因修復手段對小鼠的健康狀況和生殖力不會產生改變,且能將改變的基因遺傳給后代。Wang等[16]將含有干擾Blimp1基因功能的化膿性鏈球菌Cas9質粒通過電轉入幼鼠視網膜,觀察幼鼠體內調節視桿細胞和雙極細胞發育的分子機制。發現與視桿細胞和雙極細胞信號傳導相關的轉錄因子Blimp1的表達是由順式調控模件B108參與調控,應用CRISPR/Cas基因編輯技術敲除B108后,Blimp1的功能消失。Hung等[17]將靶向黃色熒光素蛋白YFP的sgRNA和Cas9重組,以腺病毒為載體,經玻璃體腔注射導入Thy1-YFP轉基因小鼠,5周后發現YFP-sgRNA改造組小鼠內層視網膜YFP熒光細胞的數量明顯低于對照組。
在大鼠模型中,Bakondi等[18]將含有SpCas9和sgRNA的質粒電轉入視網膜光感受器細胞,干擾含有Rho S334ter顯性突變的大鼠Rho基因,結果顯示基因干擾阻止了視網膜變性,提高了視功能。
Hong等[19]成功將紅色熒光蛋白基因轉入狗胚胎成纖維細胞,此后眼疾病動物模型逐漸應用轉基因狗模型,包括RPE65和先天性黑矇(LCA)、色盲關系的研究。至此,運用CRISPR/Cas基因編輯技術構建轉基因動物運用于眼科研究克服了克隆數量有限物種局限的障礙。雖然這些應用具有廣泛前景,但CRISPR/Cas基因編輯技術目前還未應用于大型動物模型和人體上。
2.2 CRISPR/Cas基因編輯技術與基因治療
對于進展較快且有基因缺陷的顯性遺傳疾病,可選擇合適的CRISPR/Cas基因編輯技術對其基因突變進行精確及特異性治療。在體細胞基因治療中,眼科視網膜領域基因治療最安全高效的病毒載體是腺相關病毒。但因容量較小,造成隱性遺傳病約50%的視網膜相關基因放不進去,應用受到限制。因無需考慮目的基因的大小,應用CRISPR/Cas基因編輯技術也可對這部分致病基因進行體細胞基因修復。2013年Wu等[20]在小鼠體內首次實現CRISPR/Cas基因編輯技術對顯性突變疾病的基因治療。Crygc基因顯性突變可導致白內障,基于外源寡核苷酸或者內源的WT等位序列同源重組,小鼠在受精卵時期通過共注射Cas9 mRNA和靶向sgRNA可以糾正這種突變。因此,若視網膜下腔注射能成功開展,腺病毒載體聯合CRISPR/Cas基因編輯技術可直接用于治療視網膜疾病。這種創新的治療方法較傳統的基因治療有更廣闊的應用前景:(1)運用顯性突變的基因機制進行隱性突變,將顯性基因突變成隱性基因,CRISPR/Cas系統是方便快捷的基因表達調控工具;(2)無需考慮目的基因的大小;(3)只要不敲除內源性基因,CRISPR/Cas系統可以在單細胞中保留其表達。相反,基因替代療法可能引起其拷貝數不可控增加,進而表達對細胞有毒的產物。在眼疾病的前期臨床試驗中,一項針對芳香族氨基酸脫羧酶基因改造來治愈Leber遺傳性視神經病的Ⅰ期試驗正在進行,療效令人期待[21]。
2.3 CRISPR/Cas基因編輯技術與誘導多能干細胞(iPSC)移植
人類21號染色體上有超過100個位點的突變可以導致LCA,目前LCA治療主要是以病毒載體介導的基因置換,缺陷的基因通過置換正常的基因被導入細胞并進行大量擴增[5]。而數據顯示這種治療方法的效率會隨著復制的增加而下降,并且病毒載體的基因異質性和有限性使其應用變得局限,無法應用于一些遺傳性視網膜病變[22-24]。CRISPR/Cas基因編輯技術可糾正基因突變,并不對其他基因產生影響。將其與iPSC移植共同應用有望更好的發揮其優勢。iPSC是一類特殊的有自體再生功能的細胞[25-27],將CRISPR/Cas基因編輯技術與iPSC移植共同應用,可適用于任何患者的基因突變治療且在疾病的任意階段有效。Ding等[28]報道人iPSC中,在細胞相同、載體結構相似和位點相同的情況下,CRISPR/Cas基因編輯技術的定點突變效率至少是TALENs的2倍以上,并且誘發雙等位基因的效率更高。人iPSC在治療一些人類的遺傳疾病方面具有良好的應用前景[29, 30]。采用iPSC治療人類鐮刀型細胞貧血癥,可以將患者皮膚細胞誘導成iPSC,然后利用CRISPR/Cas9突變型的切口酶介導同源重組修復突變的血紅蛋白基因,再將修復的iPSC定向誘導分化為造血干細胞移植到患者體內。此種方法既能提高同源重組效率,又能避免使用ZNFs、TALENs和CRISPR/Cas9時的脫靶效應造成的潛在危險。CRISPR/Cas基因編輯技術與人iPSC的結合應用必將對人類遺傳性疾病的治療產生巨大的影響。此將成為個體化醫療邁出的第一步,如在色素性視網膜病變的治療模型中,角質細胞或者皮膚成纖維細胞首先被去分化為iPSC,再從iPSC分化為光感受器前體細胞[31]。CRISPR/Cas基因編輯發生在iPSC或者光感受器前體細胞中,隨后再移入體內。由于移植體含有患者自身細胞表達的自身抗原,因此理論上不會產生自身免疫反應。
3 CRISPR/Cas基因編輯技術的優缺點
與同源重組技術相比,CRISPR/Cas基因編輯技術敲除效率較高,不需要藥物篩選,且可以實現多種基因的同時敲除[4]。與ZENs、TALENs技術相比,CRISPR/Cas基因編輯技術的主要優點是相對簡便, 能更方便快速的合成針對靶位點的sgRNA,從而實現剪切和編輯。應用iPSC比較TALENs和CRISPR/Cas基因編輯技術在同一位點的突變率,發現CRISPR/Cas基因編輯技術在誘導非同源末端連接的插入缺失突變和同源重組的插入修復過程中具有更高的位點特異性,并且效率更高[28, 32]。CRISPR/Cas基因編輯技術的主要缺點是存在脫靶效應和正常基因組的突變。宿主DNA和CRISPR sgRNA的17~24個堿基按堿基互補配對,早期研究證實sgRNA的后半段容許錯誤配對,導致脫靶效應[4, 10]。在將此技術應用于臨床前需要先解決高脫靶效應的弊端,進行雙鏈切口、縮短sgRNA、Cas改造和提高CRISPR/Cas系統靶位點結合的特異性可降低脫靶率[33, 34]。以聯合iPSC和CRISPR/Cas基因編輯技術為基礎的治療是否可以涉及到患者的所有細胞組,還是每一個患者在治療前需要核對細胞基因信息以合成特定序列的治療基因,也需要進一步的深入探究[35]。將該系統運用于臨床治療最重要的是安全性,脫靶效應性能分析需在臨床試驗運用前考慮完善。
許多疾病的基因組學高度復雜,涉及到基因的位點突變,染色體異位、缺失或增多。為研究基因突變對疾病產生的影響,需要有精確的模型動物。傳統模型動物構建費時費力,步驟繁瑣,甚至需要操縱胚胎干細胞。同源重組技術是最早應用在哺乳動物細胞中的基因敲除方法,隨后逐漸發展了以Cre/LoxP系統為基礎的組織特異性基因敲除技術,并利用某些標記基因對Cre誘導表達,實現基因敲除的時間調控[1]。而后報道的可誘導區域性蛋白質敲除技術、鋅指酶(ZFNs)技術和轉錄激活因子樣效應物核酸酶(TALENs)技術已實現體內基因編輯,可使構建的模式動物在數分鐘激活或敲除特定蛋白質,極大提高了基因改造的效率[2, 3]。近年發現的規律成簇的間隔短回文重復序列(CRISPR)/Cas內切酶(CRISPR/Cas)基因編輯技術是一種新型的基因改造技術[4],由于能高效改造哺乳動物的基因組,在治療空間特異性強的基因突變導致的遺傳性疾病中,CRISPR/Cas基因編輯技術具有很強的應用前景[5]。現就CRISPR/Cas基因編輯技術工作原理及其在眼科的研究進展作一綜述。
1 CRISPR/Cas基因編輯技術工作原理
CRISPR/Cas最初在鏈球菌細胞內發現[6],作為一種抵抗病毒或者噬菌體的獲得性免疫防御分子,干擾是CRISPR/Cas發揮抵御外源遺傳物質入侵最關鍵的步驟。成熟的CRISPR RNA與特異的Cas蛋白形成核糖核蛋白復合物,能與外源DNA結合并掃描其靶序列,通過CRISPR RNA的間隔序列與靶序列互補配對,外源DNA在配對的特定位置被核糖核蛋白復合物切割。間隔序列由俘獲的外源DNA組成,記錄外源遺傳物質入侵順序,類似免疫記憶,當含有同樣序列的外源DNA入侵時,可被細菌機體識別,并進行剪切使之表達沉默,達到保護自身安全的目的[7, 8]。CRISPR/Cas系統有3種類型,其中2型系統在實現其核酸酶和內切酶功能時僅需要Cas9的Cas家族蛋白輔助。Cas9為核酸內切酶,利用一段可編碼的短引導RNA序列(sgRNA),可以識別保守的間隔相鄰基序,對DNA進行雙鏈剪切(圖 1)[9, 10]。被剪切的雙鏈通過兩種方式進行修復,一種是非同源末端連接,可引起目標基因無義突變或插入缺失突變;另一種是同源重組,應用同源性模板序列對靶向序列進行基因編輯或改正。
 圖1
CRISPR/Cas9干擾外源DNA入侵示意圖
圖1
CRISPR/Cas9干擾外源DNA入侵示意圖
傳統的基因敲除技術需要經過幾代約6個月至1年甚至更長的時間才能獲得單鏈或雙鏈基因突變體,且隨著代數增高,其適用性不斷減弱。將多種不同sgRNA應用于同一CRISPR/Cas9系統即可對不同位點同時進行基因改造,實現高效,多通道基因編輯[4]。進行這種多位點CRISPR/Cas基因編輯技術改造,費用低,靈活、高效且特異性強,更方便在模型動物中大量研究某些特殊和罕見的基因突變。
2 CRISPR/Cas基因編輯技術在眼科的研究進展
由于CRISPR/Cas基因編輯技術的簡便和高效,目前在生物技術領域、基礎生物和醫學領域受到高度重視,已被應用于乙型肝炎、人類免疫缺陷病毒(HIV)、神經系統疾病和癌癥疾病模型動物中[11]。Ebina等[12]利用該技術將HIV-1啟動子沉默,在感染CRISPR/Cas9質粒的人干細胞細胞中發現HIV-1表達明顯下降。因此,可以利用CRISPR/Cas基因編輯技術對一些難以治愈的疾病進行基因修復,以恢復其正常功能。在眼科基礎研究中,CRISPR/Cas基因編輯技術首先應用于眼部視網膜基因敲除,運用電穿孔轉染視網膜細胞對基因進行改造。
2.1 CRISPR/Cas基因編輯技術在不同動物模型中的功能研究
在斑馬魚模型中,Ota等[13]利用CRISPR/Cas基因編輯技術敲除了斑馬魚胚胎中與視網膜色素上皮(RPE)色素生成相關基因gol和tyr,發現在F0代能有效產生低色素的表型,并將這種表型遺傳給后代。Chrispell等[14]也分別利用ZFNs、TALENs和CRISPR/Cas基因編輯技術對斑馬魚幼體進行基因改造。
小鼠模型中,Parikh等[15]對小鼠原核受精卵使用Cas9和sgRNA靶向絡氨酸基因敲除,除觀察小鼠毛發及眼的顏色改變外,還發現供體DNA片段如果沒有修飾,Cas9催化活性將被抑制而不啟動基因修復。這種基因修復手段對小鼠的健康狀況和生殖力不會產生改變,且能將改變的基因遺傳給后代。Wang等[16]將含有干擾Blimp1基因功能的化膿性鏈球菌Cas9質粒通過電轉入幼鼠視網膜,觀察幼鼠體內調節視桿細胞和雙極細胞發育的分子機制。發現與視桿細胞和雙極細胞信號傳導相關的轉錄因子Blimp1的表達是由順式調控模件B108參與調控,應用CRISPR/Cas基因編輯技術敲除B108后,Blimp1的功能消失。Hung等[17]將靶向黃色熒光素蛋白YFP的sgRNA和Cas9重組,以腺病毒為載體,經玻璃體腔注射導入Thy1-YFP轉基因小鼠,5周后發現YFP-sgRNA改造組小鼠內層視網膜YFP熒光細胞的數量明顯低于對照組。
在大鼠模型中,Bakondi等[18]將含有SpCas9和sgRNA的質粒電轉入視網膜光感受器細胞,干擾含有Rho S334ter顯性突變的大鼠Rho基因,結果顯示基因干擾阻止了視網膜變性,提高了視功能。
Hong等[19]成功將紅色熒光蛋白基因轉入狗胚胎成纖維細胞,此后眼疾病動物模型逐漸應用轉基因狗模型,包括RPE65和先天性黑矇(LCA)、色盲關系的研究。至此,運用CRISPR/Cas基因編輯技術構建轉基因動物運用于眼科研究克服了克隆數量有限物種局限的障礙。雖然這些應用具有廣泛前景,但CRISPR/Cas基因編輯技術目前還未應用于大型動物模型和人體上。
2.2 CRISPR/Cas基因編輯技術與基因治療
對于進展較快且有基因缺陷的顯性遺傳疾病,可選擇合適的CRISPR/Cas基因編輯技術對其基因突變進行精確及特異性治療。在體細胞基因治療中,眼科視網膜領域基因治療最安全高效的病毒載體是腺相關病毒。但因容量較小,造成隱性遺傳病約50%的視網膜相關基因放不進去,應用受到限制。因無需考慮目的基因的大小,應用CRISPR/Cas基因編輯技術也可對這部分致病基因進行體細胞基因修復。2013年Wu等[20]在小鼠體內首次實現CRISPR/Cas基因編輯技術對顯性突變疾病的基因治療。Crygc基因顯性突變可導致白內障,基于外源寡核苷酸或者內源的WT等位序列同源重組,小鼠在受精卵時期通過共注射Cas9 mRNA和靶向sgRNA可以糾正這種突變。因此,若視網膜下腔注射能成功開展,腺病毒載體聯合CRISPR/Cas基因編輯技術可直接用于治療視網膜疾病。這種創新的治療方法較傳統的基因治療有更廣闊的應用前景:(1)運用顯性突變的基因機制進行隱性突變,將顯性基因突變成隱性基因,CRISPR/Cas系統是方便快捷的基因表達調控工具;(2)無需考慮目的基因的大小;(3)只要不敲除內源性基因,CRISPR/Cas系統可以在單細胞中保留其表達。相反,基因替代療法可能引起其拷貝數不可控增加,進而表達對細胞有毒的產物。在眼疾病的前期臨床試驗中,一項針對芳香族氨基酸脫羧酶基因改造來治愈Leber遺傳性視神經病的Ⅰ期試驗正在進行,療效令人期待[21]。
2.3 CRISPR/Cas基因編輯技術與誘導多能干細胞(iPSC)移植
人類21號染色體上有超過100個位點的突變可以導致LCA,目前LCA治療主要是以病毒載體介導的基因置換,缺陷的基因通過置換正常的基因被導入細胞并進行大量擴增[5]。而數據顯示這種治療方法的效率會隨著復制的增加而下降,并且病毒載體的基因異質性和有限性使其應用變得局限,無法應用于一些遺傳性視網膜病變[22-24]。CRISPR/Cas基因編輯技術可糾正基因突變,并不對其他基因產生影響。將其與iPSC移植共同應用有望更好的發揮其優勢。iPSC是一類特殊的有自體再生功能的細胞[25-27],將CRISPR/Cas基因編輯技術與iPSC移植共同應用,可適用于任何患者的基因突變治療且在疾病的任意階段有效。Ding等[28]報道人iPSC中,在細胞相同、載體結構相似和位點相同的情況下,CRISPR/Cas基因編輯技術的定點突變效率至少是TALENs的2倍以上,并且誘發雙等位基因的效率更高。人iPSC在治療一些人類的遺傳疾病方面具有良好的應用前景[29, 30]。采用iPSC治療人類鐮刀型細胞貧血癥,可以將患者皮膚細胞誘導成iPSC,然后利用CRISPR/Cas9突變型的切口酶介導同源重組修復突變的血紅蛋白基因,再將修復的iPSC定向誘導分化為造血干細胞移植到患者體內。此種方法既能提高同源重組效率,又能避免使用ZNFs、TALENs和CRISPR/Cas9時的脫靶效應造成的潛在危險。CRISPR/Cas基因編輯技術與人iPSC的結合應用必將對人類遺傳性疾病的治療產生巨大的影響。此將成為個體化醫療邁出的第一步,如在色素性視網膜病變的治療模型中,角質細胞或者皮膚成纖維細胞首先被去分化為iPSC,再從iPSC分化為光感受器前體細胞[31]。CRISPR/Cas基因編輯發生在iPSC或者光感受器前體細胞中,隨后再移入體內。由于移植體含有患者自身細胞表達的自身抗原,因此理論上不會產生自身免疫反應。
3 CRISPR/Cas基因編輯技術的優缺點
與同源重組技術相比,CRISPR/Cas基因編輯技術敲除效率較高,不需要藥物篩選,且可以實現多種基因的同時敲除[4]。與ZENs、TALENs技術相比,CRISPR/Cas基因編輯技術的主要優點是相對簡便, 能更方便快速的合成針對靶位點的sgRNA,從而實現剪切和編輯。應用iPSC比較TALENs和CRISPR/Cas基因編輯技術在同一位點的突變率,發現CRISPR/Cas基因編輯技術在誘導非同源末端連接的插入缺失突變和同源重組的插入修復過程中具有更高的位點特異性,并且效率更高[28, 32]。CRISPR/Cas基因編輯技術的主要缺點是存在脫靶效應和正常基因組的突變。宿主DNA和CRISPR sgRNA的17~24個堿基按堿基互補配對,早期研究證實sgRNA的后半段容許錯誤配對,導致脫靶效應[4, 10]。在將此技術應用于臨床前需要先解決高脫靶效應的弊端,進行雙鏈切口、縮短sgRNA、Cas改造和提高CRISPR/Cas系統靶位點結合的特異性可降低脫靶率[33, 34]。以聯合iPSC和CRISPR/Cas基因編輯技術為基礎的治療是否可以涉及到患者的所有細胞組,還是每一個患者在治療前需要核對細胞基因信息以合成特定序列的治療基因,也需要進一步的深入探究[35]。將該系統運用于臨床治療最重要的是安全性,脫靶效應性能分析需在臨床試驗運用前考慮完善。