上海交通大學醫學院細胞分化與凋亡教育部重點實驗室的吳英理教授在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了研究性文章,報道了去泛素化蛋白酶USP7可以調控轉錄因子NOTCH1的蛋白穩定性,并初步證實USP7可能作為急性T淋巴細胞白血病干預的新靶點(http://www.nature.com/articles/s41392-018-0028-3,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”) 。該文的通訊作者是吳英理教授,第一作者為單惠莊博士。


急性T淋巴細胞白血病(T cell acute lymphoblastic leukemia,T-ALL)是一種T細胞來源的血液系統惡性腫瘤,占兒童急性淋巴細胞白血病(ALL)的10%~15%,占成人ALL的25%。T-ALL患者對化療敏感性差并易產生耐藥,大多數患者預后不良。研究表明約60%的T-ALL患者出現由NOTCH1基因突變導致的NOTCH1信號通路異常激活,并進而導致T-ALL發病。針對NOTCH1信號通路的分子靶向治療,可克服傳統化療藥物的非靶向性,有助于解決化療藥物對正常細胞和機體損傷較大的問題。
已有的研究表明,NOTCH1的蛋白穩定性同時受泛素化和去泛素化的調控,如E3泛素連接酶FBXW7(F-box and WD repeat domain containing 7)和CHIP(Carboxyl terminus of HSC70-interacting protein)可以促進活化的NOTCH1發生泛素化并進而通過蛋白酶體降解。然而維持其穩定性的去泛素化酶(Deubiquitinases,DUBs)一直未見報道。
通過對22個去泛素化酶的篩選,作者發現泛素特異性蛋白酶7(USP7)在NOTCH1胞內活性段(ICN1)的穩定性調控中起重要作用。過表達USP7可以增加NOTCH1的穩定性,而活性位點突變的USP7則不能。應用USP7抑制劑P22077抑制USP7活性,可以在T-ALL細胞系中誘導NOTCH1通過蛋白酶體途徑降解。
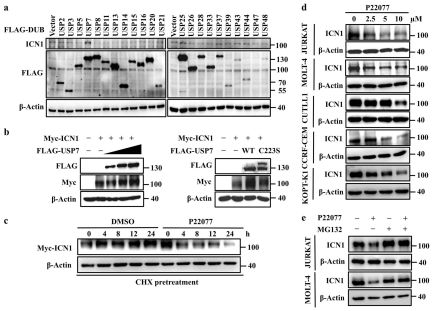
<圖1 USP7維持NOTCH1蛋白穩定性. >
內、外源免疫沉淀及GST pull-down實驗證明USP7和ICN1有相互作用,并且免疫熒光證實兩者在核內共定位。通過構建USP7的截短體,作者發現USP7的MATH結構域和UBL結構域對于ICN1的結合是十分關鍵的,而USP7的催化結構域則不能與ICN1結合。進一步的機制研究顯示,USP7是通過其去泛素蛋白酶活性來增加ICN1的穩定性的。突變USP7的活性位點或者應用USP7抑制劑均使USP7對ICN1的去泛素化活性喪失。

<圖2 USP7能夠與ICN1相互作用.>
通過對公共數據庫的分析,作者發現USP7在T-ALL細胞系及病人標本中均是高表達的。而且,在NOTCH1突變的病人中USP7的表達高于非NOTCH1突變的病人。
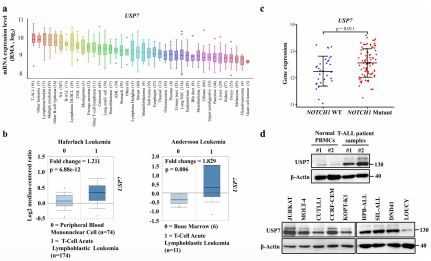
<圖3 USP7在T-ALL中高表達.>
為了進一步研究USP7在T-ALL中的功能,作者進行了敲除實驗,結果發現敲除USP7后ICN1的水平下調,并且抑制T-ALL細胞的在體外和小鼠體內的增殖。USP7的抑制劑P22077處理T-ALL細胞,也可以抑制細胞增殖,誘導細胞凋亡。這一效應也原代T-ALL細胞中亦是如此。
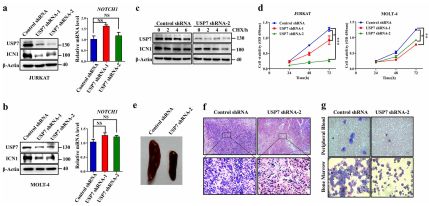
<圖4 USP7的敲低引起T-ALL細胞增殖減慢.>
綜上所述,該研究發現USP7是NOTCH1的去泛素化蛋白酶,可以通過去泛素化來穩定NOTCH1。USP7在T-ALL是高表達的。抑制USP7可導致T-ALL細胞增殖受抑、凋亡增加,在動物模型和病人標本中均有效。該研究發現了USP7在T-ALL中穩定NOTCH1的重要作用,為靶向降解NOTCH1治療T-ALL提供了新的策略。同時,也為USP7的功能多樣性提供了新的見解。
參考文獻:
(1) Yamamoto, S., Schulze, K. L. & Bellen, H. J. Introduction to Notch signaling. Methods Mol. Biol. 1187, 1–14 (2014).
(2) Weng, A. P. et al. Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia. Science 306, 269–271 (2004).
(3) Girardi, T., Vicente, C., Cools, J. & De Keersmaecker, K. The genetics and molecular biology of T-ALL. Blood 129, 1113–1123 (2017).
吳英理 教授

吳英理,教授,博導,細胞分化與凋亡教育部重點實驗室化學生物學研究組組長,上海交通大學醫學院基礎醫學院血液系統首席教師,美國血液學會會員。多年來致力于血液腫瘤細胞分化和死亡的化學生物學研究。在Journal of Cell Science、Blood、Cell Death & Disease、Nature Chemical Biology、Science Translation Medicine等期刊發表多篇研究論文。獲得國家發明專利3項。相關研究成果曾獲上海醫學科技一等獎(第二完成人)和上海市自然科學獎一等獎(第二完成人)。參與《威廉姆斯血液學》中文版的編譯,參編《化學生物學學科前沿與展望》。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Huizhuang Shan, Xiangyun Li, Xinhua Xiao, Yuting Dai, Jinyan Huang, Junjun Song, Meng Liu, Li Yang, Hu Lei, Yin Tong, Li Zhou, Hanzhang Xu & Yingli Wu. USP7 deubiquitinates and stabilizes NOTCH1 in T-cell acute lymphoblastic leukemia. Signal Transduction and Targeted Therapy. volume 3, Article number: 29 (2018) . doi.org/10.1038/s41392-018-0028-3.
點擊“閱讀原文”可查看原文并免費下載PDF