浙江大學衛生部多器官聯合移植研究重點實驗室王杭祥課題組聯合浙江大學醫學院附屬邵逸夫醫院韓衛東課題組在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的《Signal Transduction and Targeted Therapy》(STTT)上發表論文,介紹使用環孢素A和吉非替尼共載納米給藥系統治療耐藥性非小細胞肺癌。(https://www.nature.com/articles/s41392-018-0019-4,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)該文的通訊作者為王杭祥副研究員,第一作者為韓衛東副主任醫師。本工作得到了國家自然科學基金(81773193, 81571799, 81572361, 81372621)、浙江省杰出青年基金(LR16H160001)和浙江醫學2016創新學科建設項目的支持。

腫瘤的藥物治療雖然有了很大的進展和突破,但是耐藥仍然是當今臨床上遇到的最大的挑戰之一。 表皮生長因子酪氨酸激酶抑制劑(EGFR-TKIs)是目前非小細胞肺癌(NSCLC)的標準治療方式,然而幾乎所有初始對EGFR-TKIs治療敏感的NSCLC都會發展為耐藥1。免疫抑制劑環孢素A已被證明在逆轉多重耐藥,特別是逆轉腫瘤對于EGFR-TKIs的耐藥上具有很大的潛能2。在以前的研究中,韓衛東課題組發現環孢素A可以通過抑制EGFR-TKIs導致的STAT3/Bcl-2反饋性激活,從而克服NSCLC對酪氨酸激酶抑制劑吉非替尼的耐藥性3。
但是環孢素A和吉非替尼這兩種藥物的水溶性都很差4,5,所以在臨床上需要口服。由于不同的藥物在體內具有不同的代謝和藥代動力學規律,導致聯用藥物在腫瘤部位具有完全不同的分布; 因此在細胞水平藥物的協同效果并不能真實反應體內的情況。為了克服上述局限性,王杭祥課題組聯合韓衛東課題組制作了一種既能突破這兩種藥物的水溶性差的限制,又能更好地發揮環孢素A和吉非替尼聯用抗耐藥的載藥系統,并通過體內外實驗驗證這種共載給藥體系在具有不同化學結構的藥物協同給藥的有效性。
在此項研究中,合作團隊制作的聚乙二醇-聚乳酸納米粒提高了這兩種藥物的水溶性,可用于靜脈注射。體外實驗中,他們證明了無論是在吉非替尼敏感的還是耐藥的NSCLC細胞中,環孢素A都能增加這些細胞對吉非替尼的敏感性,增加腫瘤細胞的凋亡,抑制腫瘤細胞的增殖,從而顯著克服NSCLC對于吉非替尼的耐藥性(如圖1)。
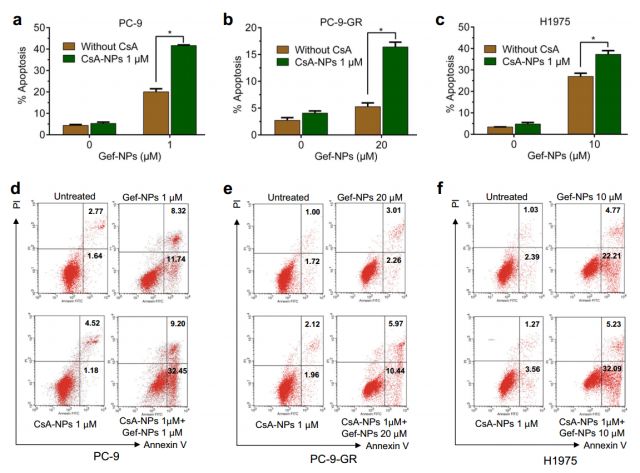
<圖1 CsA enhances the cytotoxicity of Gef when co-delivered by NPs to three NSCLC cell lines by promoting apoptosis. >
在體內實驗中,共載納米給藥系統在抑制吉非替尼耐藥細胞PC-9-GR移植瘤上具有明顯比藥物口服聯用更好的抑瘤效果。機制上,共載納米系統中的環孢素A也是通過抑制STAT3/Bcl-2信號通路的激活逆轉非小細胞肺癌細胞對于吉非替尼的耐藥(如圖2、3)。
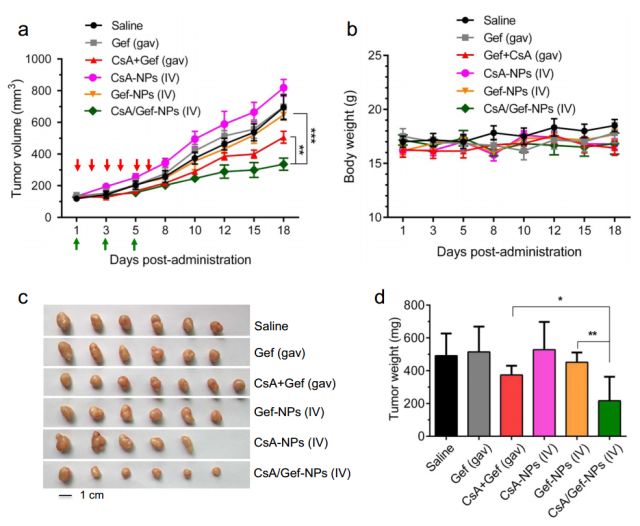
<圖2 Co-encapsulation of CsA and Gef results in improved therapeutic efficacy in an acquired EGFR-TKI-resistant PC-9-GR tumor-bearing mouse model. >
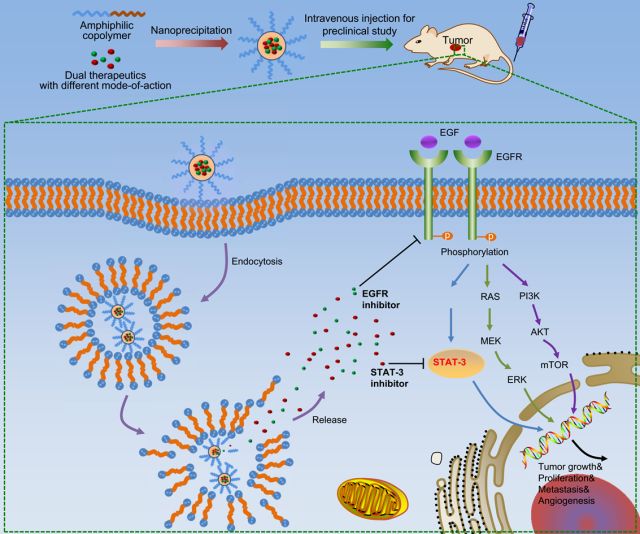
<圖3 General mechanism explaining how CsA/Gef-NPs overcome MDR and suppress cancer. >
該研究顯示這種藥物遞送系統不僅具有納米膠束的高被動靶向性,降低藥物毒副作用的特征6,還能改善具有不同分子結構的藥物的代謝規律和體內藥代動力學。該研究為克服肺癌EGFR-TKI耐藥提供了一種新的可供選擇的給藥方案,具有潛在臨床應用前景。
參考文獻
(1) Pao, W. & Chmielecki, J. Rational, biologically based treatment of EGFR-mutant non-small-cell lung cancer. Nat Rev Cancer. 10, 760-774 (2011).
(2) Qadir, M. et al. Cyclosporin A is a broad-spectrum multidrug resistance modulator. Clin Cancer Res. 11, 2320-2326 (2005).
(3) Shou J, et al. Cyclosporine A sensitizes human non-small cell lung cancer cells to gefitinib through inhibition of STAT3. Cancer Lett. 2016. 2016 Aug 28;379(1):124-33.
(4) Fahr, A. Cyclosporin Clinical Pharmacokinetics. Clin Pharmacokinet 24, 472-495 (1993).
(5) Bergman, E. et al. Pharmacokinetics of gefitinib in humans: the influence of gastrointestinal factors. Int J Pharm. 341, 134-142 (2007).
(6) Wang, H. et al. New Generation Nanomedicines Constructed from Self-Assembling Small-Molecule Prodrugs Alleviate Cancer Drug Toxicity, Cancer Res. 77, 6963-6974 (2017).
韓衛東 教授簡介

韓衛東,38歲,副研究員、副主任醫師、博士生導師,浙江省萬人計劃青年拔尖人才,浙江省杰出青年基金獲得者,兼任中國抗癌協會腫瘤靶向治療專委會委員、浙江省抗癌協會腫瘤內科專委會委員等。2008-6獲得浙江大學博士學位后進入浙江大學醫學院附屬邵逸夫醫院腫瘤內科工作至今,期間于2011.4-2012.10至美國City of Hope National Medical Center進行博士后訓練。主要研究方向:1.腸炎相關性結直腸癌發生、發展的機制研究。2.腫瘤靶向治療耐藥機制及其應對策略研究。主持國家自然基金面上項目2項,青年項目1項。至今發表SCI論文50余篇,其中一作及通訊作者30余篇,包括:Autophagy, Cancer Res, Mol Cancer Ther, Theranostics等,他引次數超過2000次。
王杭祥 教授簡介

王杭祥,38歲,副研究員、博士生導師,2010年獲得京都大學(日本)工學博士學位后進入浙江大學醫學院附屬第一醫院衛生部多器官聯合移植研究重點實驗室鄭樹森院士團隊工作。主要研究方向為基于自組裝技術的實用新型納米藥物的制備,及聯合小核酸藥物、分子靶向藥物等在抗肝癌及其他惡性腫瘤中的機制研究。主持國家自然基金面上項目2項,青年項目1項。近五年以第一或者通訊作者SCI論文30余篇,包括:Cancer Res. (2017), Angew. Chem. Int. Ed. (2014), Adv. Funct. Mater. (2015), ACS Nano (2018), Nucleic Acids Res. (2018), Theranostics (2018, 2017), ACS Appl. Mater. Interfaces (2018, 2017, 2016), Chem. Commun. (2018, 2017, 2016, 2015, 2014)等。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Weidong Han, Linlin Shi, Lulu Ren, Liqian Zhou, Tongyu Li, Yiting Qiao & Hangxiang Wang. A nanomedicine approach enables co-delivery of cyclosporin A and gefitinib to potentiate the therapeutic efficacy in drug-resistant lung cancer. Signal Transduction and Targeted Therapy volume 3, Article number: 16 (2018). doi.org/10.1038/s41392-018-0019-4.
點擊“閱讀原文”可查看原文并免費下載PDF