美國北達科他大學吳敏教授在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的《Signal Transduction and Targeted Therapy》(STTT)上發表綜述,這篇綜述重點介紹了miRNA在細菌感染進展過程中的異常表達,以及它們對宿主免疫應答的影響。治療失調的miRNA可能會成為新的傳染病的診斷、預防和治療策略。(https://www.nature.com/articles/s41392-018-0006-9,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)周西坤教授為本文的第一作者,吳敏教授為本文通訊作者。

病原菌擁有多種入侵、生存和復制的策略,可導致哺乳動物(包括人類)許多致命疾病和流行病的發生。同時,宿主的免疫系統也具有非常復雜的免疫機制來抵抗細菌感染。宿主-病原體相互作用是疾病發生、發展和進展中最重要的部分,完整的免疫系統對宿主抵抗細菌感染至關重要。人體內有許多重要的監管機制參與宿主防御感染的各種病理過程,從而調控多種生物過程。宿主的免疫細胞(如淋巴細胞、先天性淋巴細胞、巨噬細胞和嗜中性粒細胞)是先天免疫系統的重要組成部分,可通過吞噬、分泌細胞因子和加強炎癥反應來發現、處理和清除入侵的微生物。病原相關分子模式(PAMP)可與Toll樣受體(TLR)、NOD樣受體(NLR)和其他模式識別受體(PRR)相互作用以激活多種炎癥信號,并進一步產生促炎性細胞因子或細胞炎性壞死。每種類型的PAMP都可以被其特異性受體識別。隨后,適應性免疫應答也開始清除病原菌。一旦這些入侵者被清除,負免疫調節細胞因子和Th2細胞就會在平衡免疫反應中發揮重要作用,以避免過度的免疫反應和組織損傷。
最近的研究表明,微小RNA(microRNA)也參與了宿主抵抗細菌感染的免疫防御,并在其中發揮著重要作用。微小RNA(microRNA,縮寫為miRNA)是進化上保守的小的(?22個核苷酸)非編碼RNA。miRNA是許多生物過程(如細胞增殖、分化、自噬、新陳代謝和免疫反應)的關鍵調節因子。 miRNA的失調還與各種疾病相關,包括癌癥,自身免疫和心血管疾病等。
在這篇綜述中,吳敏教授首先總結了在不同細菌感染過程中發現的失調的miRNA,包括幽門螺桿菌,沙門氏菌,銅綠假單胞菌,分枝桿菌,單核細胞增多性李斯特菌,金黃色葡萄球菌,淋球菌等。例如,幽門螺桿菌可能導致多種胃部疾病,如慢性活動性胃炎、消化性潰瘍和胃癌。 目前已經有多項研究發現,幽門螺桿菌感染胃上皮細胞可導致miRNA的表達的改變,包括let-7,miR-30b,miR-210,miR-1289,miR-152 miR-200b,miR-155 ,miR-16和miR-146a。例如,在淋病奈瑟氏菌感染模型中,需要TLR4而不是TLR3來誘導巨噬細胞中的miR-718表達。 miR-718可以通過下調PTEN影響PI3K AKT信號通路,同時還能增加AKT的磷酸化和細胞因子的產生。
隨后,吳敏教授介紹了在細菌感染的過程中,miRNA與多種信號通路的相互調控作用,如 TLRsNF-κB 信號通路(如圖1),自噬(如圖2),細胞凋亡(如圖3)。
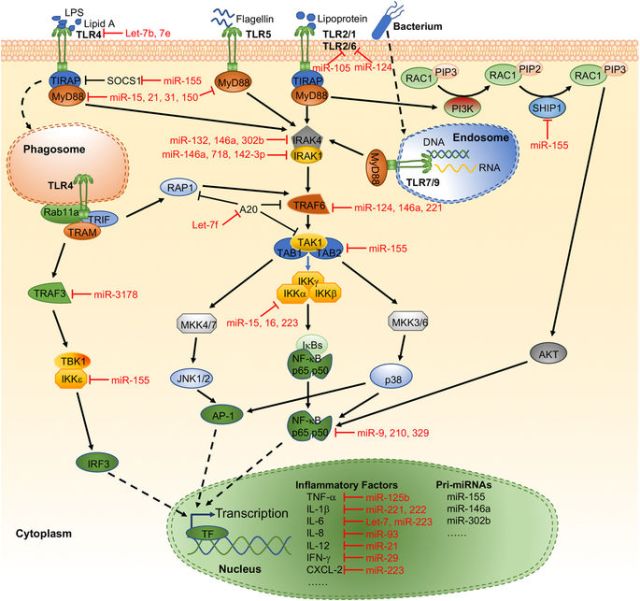
<圖1 Representative miRNAs in the regulation of TLR signaling.>
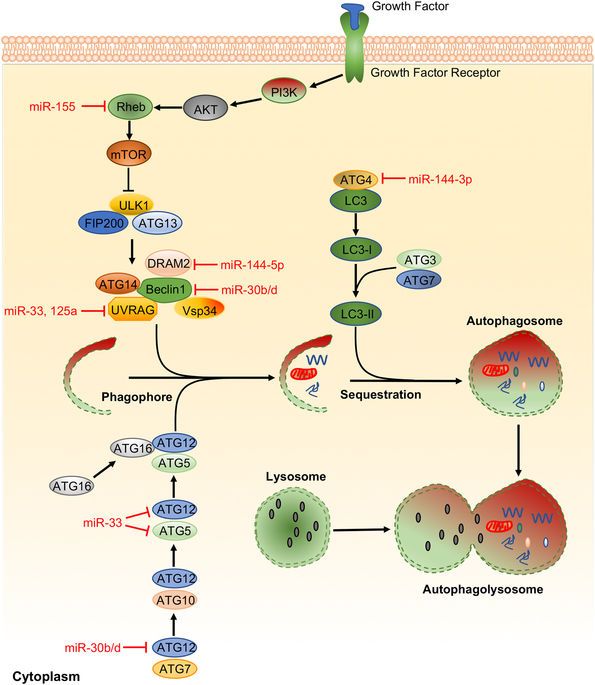
<圖2 Representative miRNAs in the regulation of autophagy.>
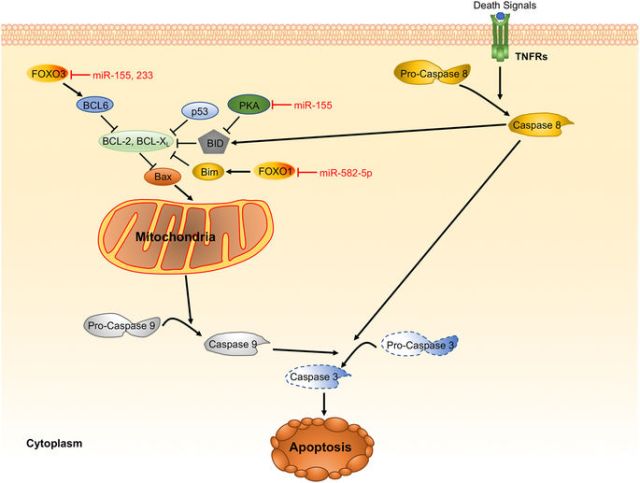
圖3 Representative miRNAs in the regulation of apoptosis.
最后,作用討論了miRNA作為診斷生物標志物和治療靶點的潛力,以及面臨的挑戰。
參考文獻
(1) Chin W, Zhong G, Pu Q, Yang C, Lou W, Florez De Sessions P, Periaswamy B, Liang ZC, Gao S, Chu CW, Bianco S, Bao C, Ding X, Tong YW, Fan W, Wu M$, Hedick J$, Yang YY$. A macromolecular therapeutic approach to eradicate multidrug resistant bacterial infections while mitigating drug resistance onset. Nat Communications 2018;9917 httprdcu.beH9rX.
(2) Li R, Tan S, Yu M, Li X, He S, Wei Y, and Wu M. Pseudomonas aeruginosa evades host immunity by Type I CRISPR-Cas mediated endogenous targeting. Cell Research 2016;26(12)1273-1287. doi 10.1038cr.2016.135. (with accompany research highlight paper and cover image). httpwww.nature.comcrjournalv26n12fullcr2016135a.html.
(3) Li X, He S, Ye Y, Zhou X, Tan S, Jundt M.C., Lenz C, Lichter N, Hidebrand A, Wang Y, Li G, Huang C, and Wu M. Lyn delivers bacterial substance to lysosomes for eradication through TLR-2-initiated and autophagy-mediated phagocytosis. PLoS Pathogens 2016 Jan 6;12(1)e1005363. doi 10.1371journal.ppat.1005363.
吳敏 教授簡介

吳敏教授目前就任美國北達科他州大學醫學院教授(終身)。主要研究gram-negative細菌的發病機制(銅綠假單胞菌呼吸道感染和宿主-病原體相互作用),涉及自噬、非編碼RNA和CRISPR-Cas過繼性免疫系統對炎癥反應調節。作為國際知名的肺部生物學和假單胞菌感染的科學家,吳教授首次確定了自噬介導的細菌宿主防御機制以及炎癥調節中的microRNAs,在細菌感染研究方面做出了一系列創新性研究,獲得了包括英國海外研究學生獎、泰特利勒普頓獎學金和北達科他大學合作研究獎等多個獎項,并在Cell Res, Nat Commun, Nat Microbiol, PNAS, Am J Respir Crit Care Med, Autophagy等國際知名雜志發表高水平SCI論文120余篇,擔任Nanomedicine, J Immunol 等雜志副主編,也擔任Nat Commun, Nat Microbiol, PNAS, Gastroenterology, Am J Respir Crit Care Med, Cell Res等知名學術刊物特邀審稿人,同時還作為評審專家參與中國“長江學者”特聘教授和“青年千人計劃”評審。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Xikun Zhou, Xuefeng Li & Min Wu. miRNAs reshape immunity and inflammatory responses in bacterial infection. Signal Transduction and Targeted Therapyvolume 3, Article number 14 (2018) doi10.1038s41392-018-0006-9
點擊“閱讀原文”可查看原文并免費下載PDF
美國北達科他大學吳敏教授在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的《Signal Transduction and Targeted Therapy》(STTT)上發表綜述,這篇綜述重點介紹了miRNA在細菌感染進展過程中的異常表達,以及它們對宿主免疫應答的影響。治療失調的miRNA可能會成為新的傳染病的診斷、預防和治療策略。(https://www.nature.com/articles/s41392-018-0006-9,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)周西坤教授為本文的第一作者,吳敏教授為本文通訊作者。

病原菌擁有多種入侵、生存和復制的策略,可導致哺乳動物(包括人類)許多致命疾病和流行病的發生。同時,宿主的免疫系統也具有非常復雜的免疫機制來抵抗細菌感染。宿主-病原體相互作用是疾病發生、發展和進展中最重要的部分,完整的免疫系統對宿主抵抗細菌感染至關重要。人體內有許多重要的監管機制參與宿主防御感染的各種病理過程,從而調控多種生物過程。宿主的免疫細胞(如淋巴細胞、先天性淋巴細胞、巨噬細胞和嗜中性粒細胞)是先天免疫系統的重要組成部分,可通過吞噬、分泌細胞因子和加強炎癥反應來發現、處理和清除入侵的微生物。病原相關分子模式(PAMP)可與Toll樣受體(TLR)、NOD樣受體(NLR)和其他模式識別受體(PRR)相互作用以激活多種炎癥信號,并進一步產生促炎性細胞因子或細胞炎性壞死。每種類型的PAMP都可以被其特異性受體識別。隨后,適應性免疫應答也開始清除病原菌。一旦這些入侵者被清除,負免疫調節細胞因子和Th2細胞就會在平衡免疫反應中發揮重要作用,以避免過度的免疫反應和組織損傷。
最近的研究表明,微小RNA(microRNA)也參與了宿主抵抗細菌感染的免疫防御,并在其中發揮著重要作用。微小RNA(microRNA,縮寫為miRNA)是進化上保守的小的(?22個核苷酸)非編碼RNA。miRNA是許多生物過程(如細胞增殖、分化、自噬、新陳代謝和免疫反應)的關鍵調節因子。 miRNA的失調還與各種疾病相關,包括癌癥,自身免疫和心血管疾病等。
在這篇綜述中,吳敏教授首先總結了在不同細菌感染過程中發現的失調的miRNA,包括幽門螺桿菌,沙門氏菌,銅綠假單胞菌,分枝桿菌,單核細胞增多性李斯特菌,金黃色葡萄球菌,淋球菌等。例如,幽門螺桿菌可能導致多種胃部疾病,如慢性活動性胃炎、消化性潰瘍和胃癌。 目前已經有多項研究發現,幽門螺桿菌感染胃上皮細胞可導致miRNA的表達的改變,包括let-7,miR-30b,miR-210,miR-1289,miR-152 miR-200b,miR-155 ,miR-16和miR-146a。例如,在淋病奈瑟氏菌感染模型中,需要TLR4而不是TLR3來誘導巨噬細胞中的miR-718表達。 miR-718可以通過下調PTEN影響PI3K AKT信號通路,同時還能增加AKT的磷酸化和細胞因子的產生。
隨后,吳敏教授介紹了在細菌感染的過程中,miRNA與多種信號通路的相互調控作用,如 TLRsNF-κB 信號通路(如圖1),自噬(如圖2),細胞凋亡(如圖3)。

<圖1 Representative miRNAs in the regulation of TLR signaling.>

<圖2 Representative miRNAs in the regulation of autophagy.>

圖3 Representative miRNAs in the regulation of apoptosis.
最后,作用討論了miRNA作為診斷生物標志物和治療靶點的潛力,以及面臨的挑戰。
參考文獻
(1) Chin W, Zhong G, Pu Q, Yang C, Lou W, Florez De Sessions P, Periaswamy B, Liang ZC, Gao S, Chu CW, Bianco S, Bao C, Ding X, Tong YW, Fan W, Wu M$, Hedick J$, Yang YY$. A macromolecular therapeutic approach to eradicate multidrug resistant bacterial infections while mitigating drug resistance onset. Nat Communications 2018;9917 httprdcu.beH9rX.
(2) Li R, Tan S, Yu M, Li X, He S, Wei Y, and Wu M. Pseudomonas aeruginosa evades host immunity by Type I CRISPR-Cas mediated endogenous targeting. Cell Research 2016;26(12)1273-1287. doi 10.1038cr.2016.135. (with accompany research highlight paper and cover image). httpwww.nature.comcrjournalv26n12fullcr2016135a.html.
(3) Li X, He S, Ye Y, Zhou X, Tan S, Jundt M.C., Lenz C, Lichter N, Hidebrand A, Wang Y, Li G, Huang C, and Wu M. Lyn delivers bacterial substance to lysosomes for eradication through TLR-2-initiated and autophagy-mediated phagocytosis. PLoS Pathogens 2016 Jan 6;12(1)e1005363. doi 10.1371journal.ppat.1005363.
吳敏 教授簡介

吳敏教授目前就任美國北達科他州大學醫學院教授(終身)。主要研究gram-negative細菌的發病機制(銅綠假單胞菌呼吸道感染和宿主-病原體相互作用),涉及自噬、非編碼RNA和CRISPR-Cas過繼性免疫系統對炎癥反應調節。作為國際知名的肺部生物學和假單胞菌感染的科學家,吳教授首次確定了自噬介導的細菌宿主防御機制以及炎癥調節中的microRNAs,在細菌感染研究方面做出了一系列創新性研究,獲得了包括英國海外研究學生獎、泰特利勒普頓獎學金和北達科他大學合作研究獎等多個獎項,并在Cell Res, Nat Commun, Nat Microbiol, PNAS, Am J Respir Crit Care Med, Autophagy等國際知名雜志發表高水平SCI論文120余篇,擔任Nanomedicine, J Immunol 等雜志副主編,也擔任Nat Commun, Nat Microbiol, PNAS, Gastroenterology, Am J Respir Crit Care Med, Cell Res等知名學術刊物特邀審稿人,同時還作為評審專家參與中國“長江學者”特聘教授和“青年千人計劃”評審。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Xikun Zhou, Xuefeng Li & Min Wu. miRNAs reshape immunity and inflammatory responses in bacterial infection. Signal Transduction and Targeted Therapyvolume 3, Article number 14 (2018) doi10.1038s41392-018-0006-9
點擊“閱讀原文”可查看原文并免費下載PDF