美國哈佛大學醫學院Dana-Farber癌癥研究所Donald William Kufe教授在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的《Signal Transduction and Targeted Therapy》(STTT)上發表研究論文,發現靶向對ABT-737耐藥的三陰性乳腺癌細胞中的MUC1-C可以抑制BCL2A1并誘導死亡,這很可能成為新的治療三陰性乳腺癌策略。(https://www.nature.com/articles/s41392-018-0013-x,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)Masayuki Hiraki博士為本文的第一作者,Donald William Kufe教授為通訊作者。

三陰性乳腺癌(triple negative breast cancer, TNBC)是指雌激素受體(ER)、孕激素受體(PR)和人表皮生長因子受體2(Her-2)均為陰性的一種乳腺癌。三陰性乳腺癌占所有乳腺癌病理類型的15%-23.8%,三陰性乳腺癌具有侵襲力強、惡性程度高等特點,三陰性乳腺癌目前尚沒有有效的治療方式,對其它類型的乳腺癌有效的內分泌治療和分子靶向(如靶向Her-2的曲妥珠單抗)對TNBCs均無效。目前,三陰性乳腺癌主要依靠化療,但治療后愈很差,且無復發生存率和總生存率均相對較低。B細胞淋巴瘤2相關蛋白A1(BCL2A1)是BCL-2抗凋亡蛋白家族的一員,其癌癥細胞對化療藥物和靶向藥物的耐藥相關。BCL2A1通過阻斷細胞死亡發揮癌基因的功能。目前,在三陰性乳腺癌中發現了BCL2A1的過表達,然而,目前還沒有有效的藥物能靶向過度表達的BCL2A1,從而治療癌癥。
黏蛋白1(MUC1)是一種在約90%的三陰性乳腺癌中過表達的異二聚體蛋白。MUC1跨膜C-末端(MUC1-C)起到癌蛋白的作用,它可與多種激酶和效應物進行相互作用,影響多條信號通路。例如, MUC1-C能激活與炎癥相關的TGF-β激活激酶1(TAK1),進而影響 TAK1→IKK→NF-κB p65通路。MUC1-C胞內結構域直接與NF-κB p65相互作用,促進NF-κB p65靶基因的活化,其中包括MUC1,進而形成自誘導循環,增加MUC1-C的表達。目前有研究表明,MUC1-C還能通過NF-κB p65依賴性機制增加抗凋亡BCL-x蛋白的表達,此外MUC1-C在三陰性乳腺癌細胞對BCL-2抑制劑的氧化應激反應中穩定MCL-1。但目前的研究還未發現MUC1-C信號通路與BCL2A1之間有關系。
為研究兩者的關系,Donald Kufe教授課題組在針對三陰性乳腺癌細胞MDA-MB-468和BT-20的研究發現, MUC1-C誘導BCL2A1表達(圖1)。
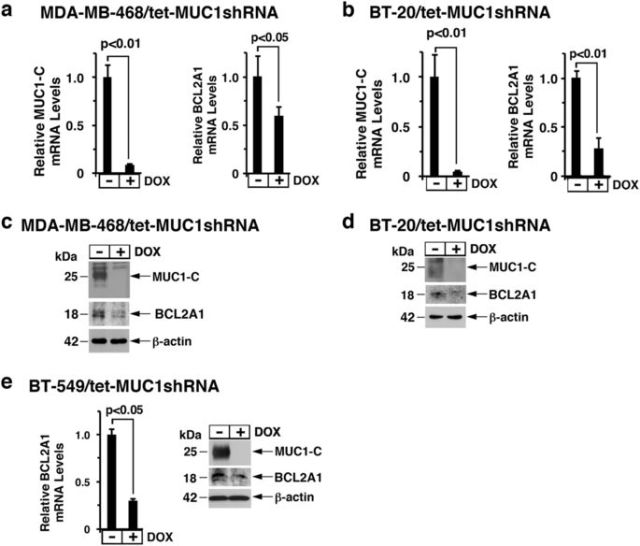
<圖1 Downregulation of MUC1-C decreases BCL2A1 expression.>
隨后,研究人員使用靶向CQC基序并抑制MUC1-C同源二聚化的GO-203肽(圖2a)進行研究,GO-203肽已被納入用于遞送到腫瘤細胞中的納米顆粒聚合物中(GO-203 / NP),研究表明靶向MUC1-C能抑制BCL2A1的表達。
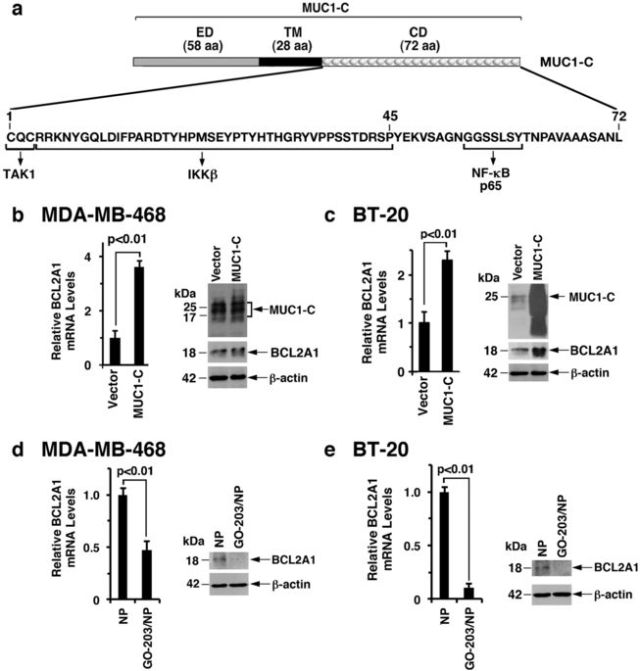
<圖2 MUC1-C drives BCL2A1 expression.>
進一步的研究發現,MUC1-C是通過NF-κB p65介導的機制促進BCL2A1的轉錄(圖3)。
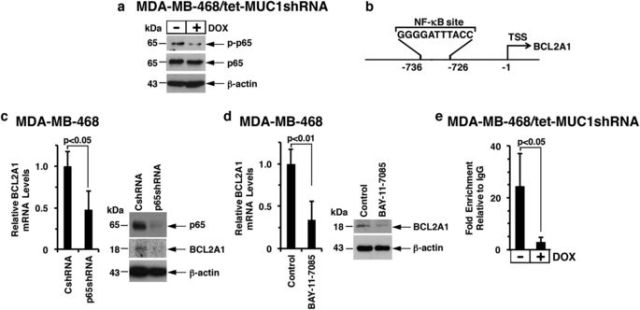
<圖3 MUC1-C→NF-κB p65 signaling induces BCL2A1 expression.>
隨后,研究人員發現,三陰性乳腺癌對ABT-737和ABT-263這類靶向BCL的藥物耐藥與MUC1-C→NF-κB→BCL2A1途徑的激活有關。而使用靶向MUC1-C的GO-203 / NP能有效抑制ABT-737耐藥三陰性乳腺癌中的BCL2A1,從而治療三陰性乳腺癌(圖4,圖5)。
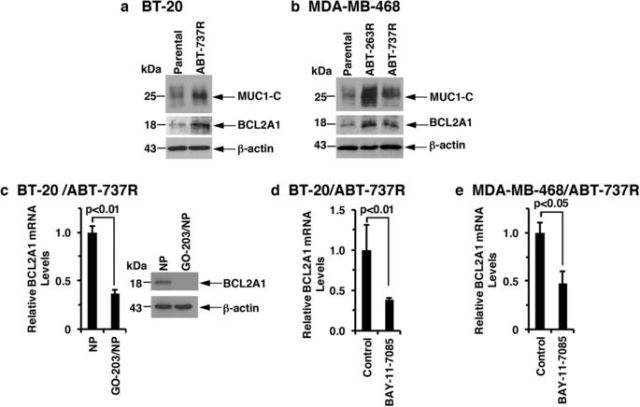
<圖4 MUC1-C→NF-κB signaling upregulates BCL2A1 in ABT-737-resistant cells.>
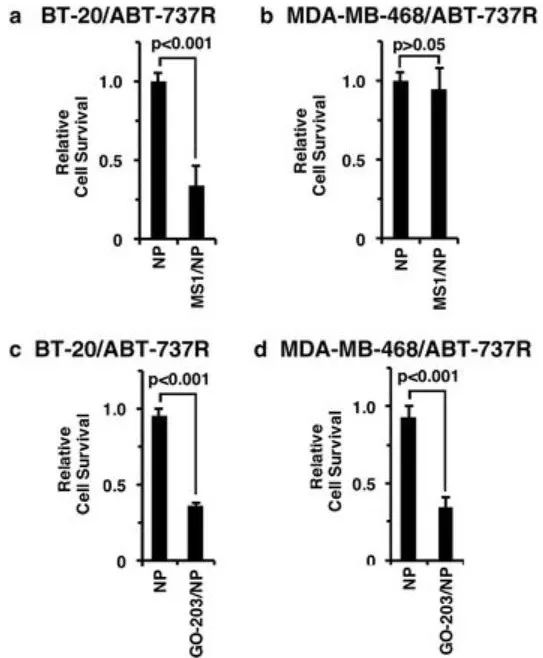
<圖5 Targeting MUC1-C is effective against ABT-resistant cells with BCL2A1 overexpression>
綜上,本研究發現,MUC1-C通過NF-κB p65依賴性機制在TNBC細胞中誘導BCL2A1的表達。實驗顯示MUC1-C→NF-κB p65→BCL2A1通路對于用針對BCL-2家族的其他成員的藥物(例如ABT-737)的治療反應極為敏感。進一步的研究表明靶向MUC1-C能有效下調對ABT-737耐藥的TNBC細胞中的BCL2A1,進而治療三陰性乳腺癌(圖6)。
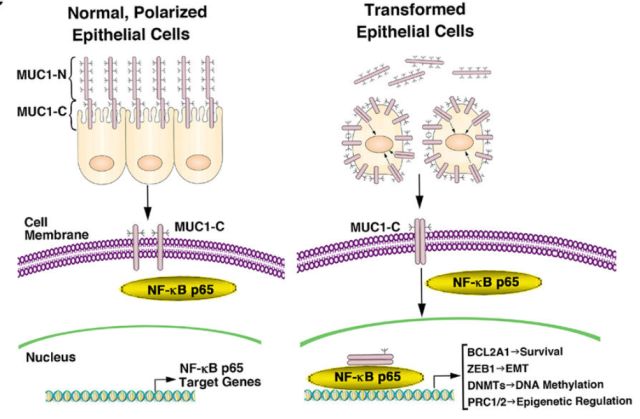
<圖6 Schema depicting the function of the MUC1-C→NF-κB p65 pathway in integrating the induction
of BCL2A1 expression with the EMT program and epigenetic regulation.>
參考文獻
(1) Kufe, D. MUC1-C oncoprotein as a target in breast cancer: activation of signaling pathways and therapeutic approaches. Oncogene 32, 1073–1081 (2013).
(2) Kufe, D. Mucins in cancer: function, prognosis and therapy. Nat. Rev. Cancer 9, 874–885 (2009).
(3) Alam, M., Rajabi, H., Ahmad, R., Jin, C. & Kufe, D. Targeting the MUC1-C oncoprotein inhibits self-renewal capacity of breast cancer cells. Oncotarget 5, 2622–2634 (2014).
(4) Rajabi, H. & Kufe, D. MUC1-C oncoprotein integrates a program of EMT, epigenetic reprogramming and immune evasion in human carcinomas. Biochim. Biophys. Acta 1868, 117–122 (2017).
Donald William Kufe 教授簡介

Donald William Kufe教授目前就職于美國哈佛大學醫學院Dana-Farber癌癥研究所。Kufe博士于1970年獲得羅徹斯特大學醫學院的醫學博士學位。隨后在Dana-Farber癌癥研究所擔任臨床研究員,他于1979年正式成為Dana-Farber癌癥研究所的員工。他曾擔任癌癥藥理學部門主任,Dana-Farber癌癥中心副主任,哈佛臨床1期研究組的組長和腫瘤學實驗治療計劃的領導。Kufe教授已經發表了SCI論文近200篇,包括Sci Transl Med, Blood, JCI, Cancer Res等。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Masayuki Hiraki, Takahiro Maeda, Neha Mehrotra, Caining Jin, Maroof Alam, Audrey Bouillez, Tsuyoshi Hata, Ashujit Tagde, Amy Keating, Surender Kharbanda, Harpal Singh & Donald Kufe. Targeting MUC1-C suppresses BCL2A1 in triple-negative breast cancer. Signal Transduction and Targeted Therapyvolume 3, Article number: 13 (2018). doi:10.1038/s41392-018-0013-x
點擊“閱讀原文”可查看原文并免費下載PDF