美國喬治亞大學Y. George Zheng教授在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了研究性文章,采用停止流動熒光檢測方式開發PRMT1抑制劑,采用這種方法不僅能用該篩選PRMT1的小分子抑制劑,同時還能確認該小分子抑制劑的作用機制。(http://www.nature. com/articles/sigtrans20175,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)。該文的通訊作者是Y. George Zheng教授,第一作者是Kun Qian博士。

蛋白質精氨酸甲基轉移酶(PRMTs)是真核生物中至關重要的表觀遺傳調節因子,可作為染色質重塑的組蛋白編寫者(writer)。 PRMTs還能甲基化多種非組蛋白底物以調節其功能和活性。越來越多的證明表明甲基轉移酶蛋白在多種生物學過程和疾病中發揮著至關重要的作用。研究發現,PRMT1負責細胞內大多數(85%以上)的I型甲基轉移。PRMT1催化H4R3 (H4R3me2a)的不對稱的甲基轉移,從而影響基因的轉錄激活(圖1 A)。除此之外,PRMT1還參與RNA剪接、DNA修復和信號轉導。PRMT1已與人類端粒有關,并能直接參與Akt信號傳導通路,同時,大量的非組蛋白底物也是PRMT1的底物,如DNA修復蛋白MRE11,p53結合蛋白1(53BP1),CSNK1a1激酶,HIF-1等。鑒于PRMT1在體內的重要作用,它的異常表達與多種疾病有關。PRMT1與心血管疾病和炎癥反應一定的關系,如糖尿病和高血壓。在乳腺癌,前列腺癌,肺癌,結腸癌,膀胱癌和白血病等癌癥中可以觀察到PRMT1的過表達或是異常剪接。PRMT1是目前藥物開發領域的熱點,然而遺憾的是,目前并沒有太多有效的PRMT1小分子抑制劑。
同時,目前已經報道的多數PRMT1的抑制劑都缺乏明確的作用機制信息。從 PRMTs的晶體結構中可以發現, PRMTs有兩個相鄰的結合位點,共作用因子SAM結合位點和底物結合位點,對于共作用因子SAM結合位點,所有的PRMTs的SAM結合位點都非常相似; 對于底物結合位點,所有的PRMTs在底物結合位點都擁有一條非常保守的Double-E loop,精氨酸殘基可以與Double-E loop上的兩個非常重要的谷氨酸殘基和兩個谷氨酸中間的蛋氨酸/亮氨酸的骨架形成氫鍵相互作用。這樣的高度保守性使得找到選擇性作用于某一特定的PRMTs蛋白的抑制劑非常困難,特別是I型PRMTs的選擇性抑制劑。因此PRMTs的小分子抑制劑可分為共同作用因子競爭性抑制劑、底物競爭性抑制劑和同時作用于兩個位點的混合型抑制劑。
為開發更好的PRMT1小分子抑制劑,美國喬治亞大學Y. George Zheng教授團隊為PRMT1抑制劑開發和作用基質的研究建立了一種基于流動熒光的停止檢測方法。首先,使用熒光肽H4FL研究PRMT1介導的精氨酸甲基化,并建立 相關的動力學模型(如圖1B)。
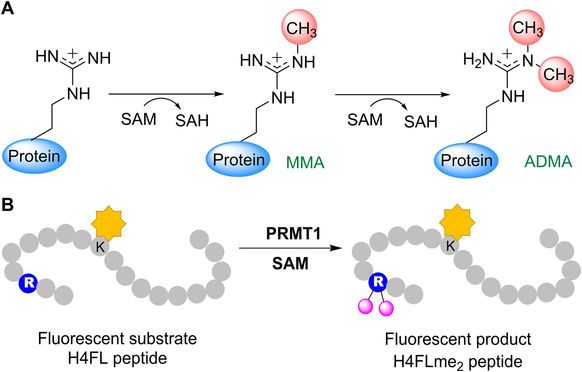
<圖1 Arginine methylation by PRMT1. Arginine methylation by PRMT1. a PRMT1-mediated methylation reaction. b Use of the fluorescent peptide H4FL to study PRMT1-mediated arginine methylation.>
為了驗證該模型的正確性,Y. George Zheng教授團隊分別采用了共同作用因子競爭性抑制劑SAH(圖2)和西奈芬近(sinefungin)、底物競爭性抑制劑H4R3me2a(圖3)對該模型進行了驗證,驗證結果表明,放假模型能很好的區分兩種類型的抑制劑并能準確測量出抑制劑的IC50。
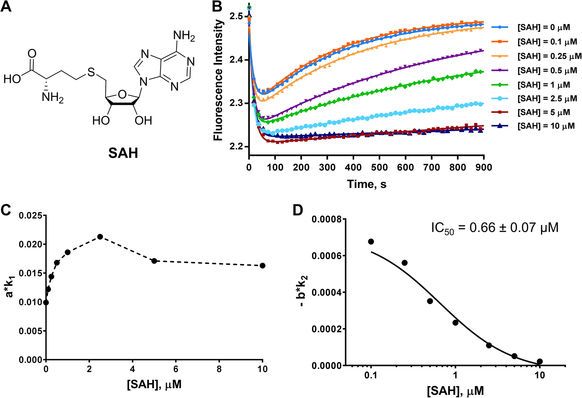
<圖2 Stopped flow fluorescence assay of the cofactor-competitive inhibitor SAH.?a?Structure of SAH.>
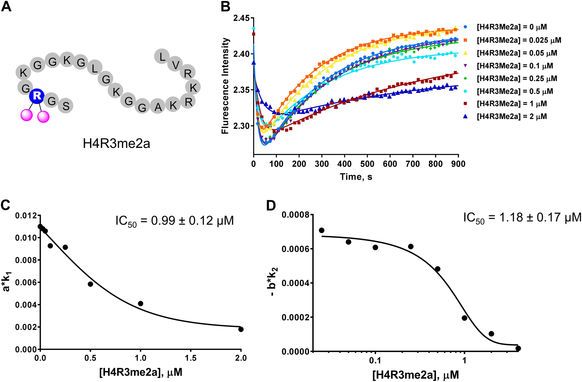
<圖3 Stopped flow fluorescence assay of the substrate-competitive inhibitor H4R3Me2a. a Illustration of H4R3Me2a.>
隨后,為了進一步驗證該方法的有效性,Y. George Zheng教授團隊還驗證了有名的PRMT1抑制劑DB75 (furamidine)(圖4)以及最近發現的MS023(參考文獻1)。對DB75的檢測確認了DB75是底物競爭性抑制劑,且測得的IC50也與之前報道的數值相近。
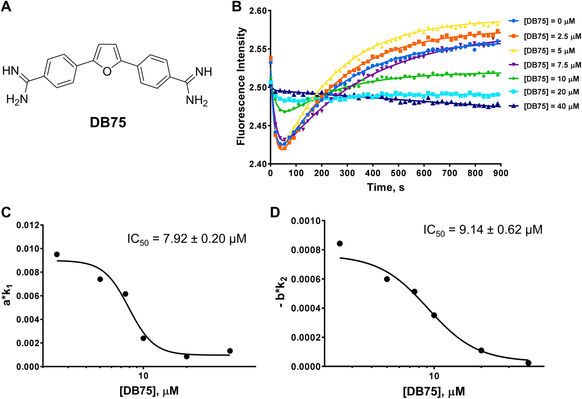
<圖4 Stopped flow fluorescence assay of DB75.>
對MS023檢測的結果則比較特殊,該結果(圖5)與底物競爭性抑制劑(例如DB75和H4R3me2a)或共作用因子競爭性抑制劑(例如SAH和sinefungin)的結果不同。MS023可能是一種混合型非競爭性抑制劑,部分具有底物競爭性。 事實上,先前有報道顯示MS023的既不與共作用因子競爭SAM競爭,也不與底物競爭;而根據與MS023與PRMT6的X射線共晶體結構,MS023抑制劑占據了底物精氨酸 結合位點。
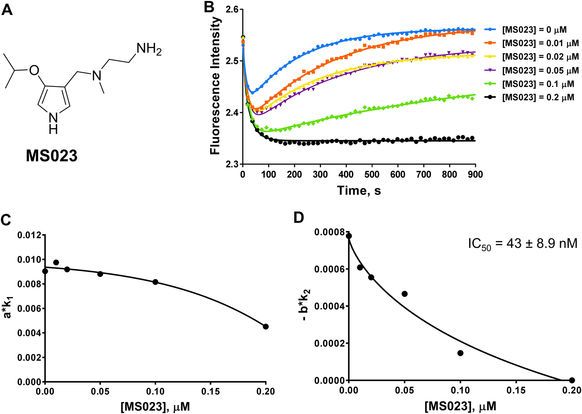
<圖5 Stopped flow fluorescence assay of MS023.>
綜上所述,該方法是目前PRMT1抑制劑檢測方法具有同質,非放射性和混合測量的優點,可以連續測量甲基化反應及其抑制活性。該方法不僅能夠定量確定PRMT1抑制劑的效力(IC50),還能夠確認抑制劑的作用機制,區分輔因子競爭性抑制劑,底物競爭性抑制劑和混合型抑制劑。
參考文獻
(1) Kaniskan, H. ü. et al. A potent, selective and cell-active allosteric inhibitor of protein arginine methyltransferase 3 (PRMT3). Angew. Chem. Int. Ed. Engl. 54, 5166–5170 (2015).
(2)Hu, H., Qian, K., Ho, M. C. & Zheng, Y. G. Small molecule inhibitors of protein arginine methyltransferases. Expert Opin. Invest Drugs 25, 335–358 (2016).
(3)Qian, K. & Zheng, Y. G. Current development of protein arginine methyltransferase inhibitors. In: J. Medina-Franco (ed). EPI-Informatics: Discovery and Development of Small Molecule Epigenetic Drugs and Probes 231–256. (Elsevier, Amsterdam, 2016).
(4)Li, K. K., Luo, C., Wang, D., Jiang, H. & Zheng, Y. G. Chemical and biochemical approaches in the study of histone methylation and demethylation. Med. Res. Rev. 32, 815–867 (2012).
(5)Wu, J., Xie, N., Feng, Y. & Zheng, Y. G. Scintillation proximity assay of arginine methylation. J. Biomol. Screen. 17, 237–244 (2012).
(6)Hu, H., Luo, C. & Zheng, Y. G. Transient kinetics define a complete kinetic model for protein arginine methyltransferase 1. J. Biol. Chem. 291, 26722–26738 (2016).
(7)Feng, Y., Xie, N., Wu, J., Yang, C. & Zheng, Y. G. Inhibitory study of protein arginine methyltransferase 1 using a fluorescent approach. Biochem. Biophys. Res. Commun. 379, 567–572 (2009).
(8)Wu, J. & Zheng, Y. G. Fluorescent reporters of the histone acetyltransferase. Anal. Biochem. 380, 106–110 (2008).
Y. George Zheng 教授簡介

Y. George Zheng教授目前就職于美國喬治亞大學,鄭教授的實驗室致力于化學、生物學和醫學的最前沿領域。目前活躍的研究領域包括:(1)開發有效和選擇性的表觀遺傳小分子抑制劑,(2)設計用于研究蛋白質乙酰化和新型賴氨酸酰化的化學探針,以及(3)蛋白質精氨酸甲基化的機理和功能研究。目前已經發表SCI論文70余篇。
個人主頁: http://pbs.rx.uga.edu/people/faculty-members/ yujun-george-zheng/
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Kun Qian, Hao Hu, Hui Xu & Y George Zheng. Detection of PRMT1 inhibitors with stopped flow fluorescence. Signal Transduction and Targeted Therapy. volume 3, Article number: 6 (2018) doi:10.1038/ s41392-018-0009-6.
點擊“閱讀原文”可查看原文并免費下載PDF