美國弗吉尼亞大學醫學院的Mark Kester教授于2017年在自然出版社與四川大學華西醫院生物治療國家重點實驗室聯合主辦的期刊《Signal Transduction and Targeted Therapy》(STTT)上發表研究性論文:STAT3介導C6-神經酰胺(CNL)誘導的慢性淋巴細胞性白血病細胞死亡。該研究結果提示可聯合CNL與BTK抑制劑聯合治療慢性淋巴細胞性白血病。Mark Kester教授是該文章的通訊作者,第一作者為Ushma A Doshi博士。

慢性淋巴細胞白血病(CLL)是一種B淋巴細胞惡性腫瘤,其特征是表達CD5、CD19、CD20和CD23的腫瘤性B淋巴細胞在骨髓、外周血和淋巴結中克隆擴增和積累。使用氟達拉濱、環磷酰胺和利妥昔單抗的標準治療方案的總體反應率約為90%,完全緩解為72%。 盡管治療方面取得了這些進展,CLL依然是不治之癥。
大量證據表明,神經酰胺增強信號級聯導致細胞死亡。但由于溶解度有限,神經酰胺無法通過傳統的遞藥系統進入細胞內。基于此,Mark Kester教授的實驗室已經開發了一種納米脂質體的C6-神經酰胺(CNL)制劑,CNL在多種癌癥體內模型中都有明顯的抑制腫瘤的效果[1-7]。CNL能選擇性地殺死癌細胞,目前正在進行治療晚期實體瘤的臨床試驗。特別是在CLL中,Mark Kester教授已經證明,CNL選擇性地靶向甘油醛-3-磷酸脫氫酶抑制Warburg效應并抑制CLL在鼠模型中生長[7]。此外,研究還發現,在CLL中,抑制細胞內神經酰胺的積累可以防止氟達拉濱誘導的細胞凋亡。而PI3K和BTK的抑制劑(如GS-1101和ibrutinib)可以通過增加細胞內神經酰胺和同時降低葡萄糖神經酰胺的水平來克服B細胞受體介導的CLL細胞的存活。總之,這些數據表明,神經酰胺能有效治療CLL。
在本文中,Mark Kester教授發現STAT3是CLL的潛在治療靶點,如圖1, 體外和體內實驗表明CNL能抑制STAT3的磷酸化,進一步研究發現CNL能抑制STAT3的Y705和S727的磷酸化,如圖2。
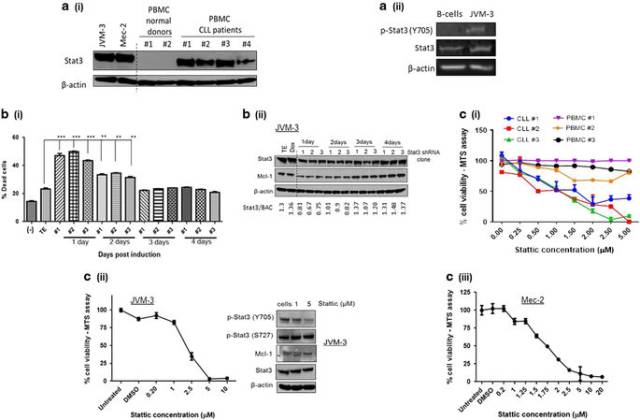
<圖1 STAT3 is a potential therapeutic target in CLL.>
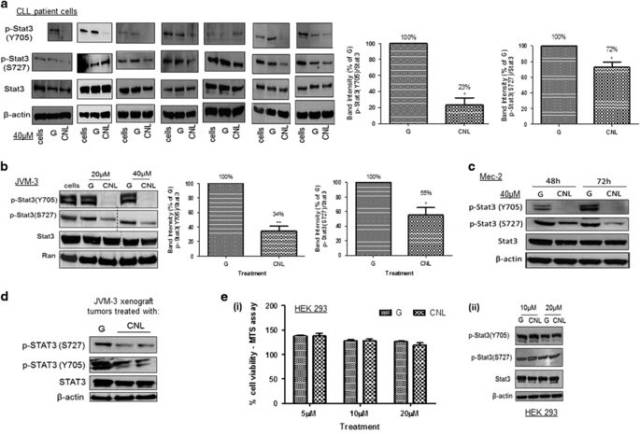
<圖2 CNL suppresses the phosphorylation of STAT3 at both Y705 and S727 residues.>
研究表明,CNL誘導CLL細胞壞死性細胞死亡, 而CNL抑制STAT3磷酸化是其關鍵因素,進一步的研究發現,CNL能抑制STAT3上游激酶,包括Bruton酪氨酸激酶(BTK),見圖3,同時CNL抑制STAT3的轉錄活性,見圖4。
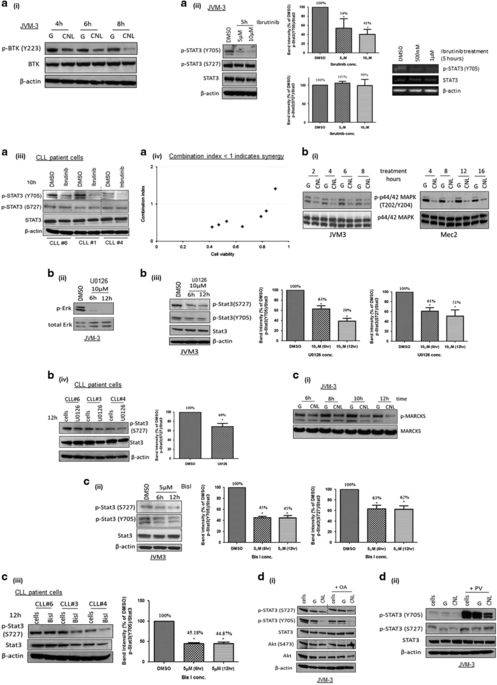
<圖3 CNL suppresses STAT3 phosphorylation via multiple kinases including BTK.>
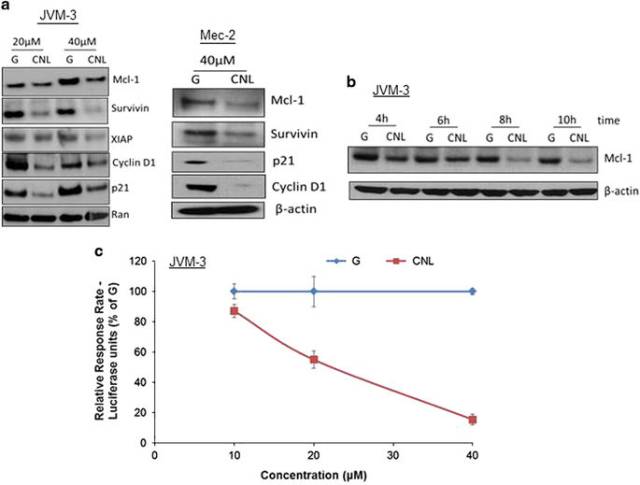
<圖4 CNL suppresses the transcriptional activity of STAT3.>
綜上,該研究揭示了STAT3在CNL 治療CLL中發揮的重要作用。同時,研究結果提示聯合應用CNL和BTK抑制劑ibrutinib可增強治療效果,這也為CLL的治療提供了新的策略。(PS:目前CNL已經進入臨床實驗階段,Investigational New Drug# 109471; Clinical trial#:NCT02834611)。
參考文獻:
(1)Liu X, Ryland L, Yang J, Liao A, Aliaga C, Watts R et al. Targeting of survivin by nanoliposomal ceramide induces complete remission in a rat model of NK-LGL leukemia. Blood 2010; 116: 4192–4201.
(2)Tran MA, Smith CD, Kester M, Robertson GP. Combining nanoliposomal ceramide with sorafenib synergistically inhibits melanoma and breast cancer cell survival to decrease tumor development. Clin Cancer Res 2008; 14: 3571–3581.
(3)Watters RJ, Fox TE, Tan SF, Shanmugavelandy S, Choby JE, Broeg K et al. Targeting glucosylceramide synthase synergizes with C6-ceramide nanoliposomes to induce apoptosis in natural killer cell leukemia. Leuk Lymphoma 2013; 54: 1288–1296.
(4)Stover TC, Sharma A, Robertson GP, Kester M. Systemic delivery of liposomal short-chain ceramide limits solid tumor growth in murine models of breast adenocarcinoma. Clin Cancer Res 2005; 11: 3465–3474.
(5)Tagaram HR, Divittore NA, Barth BM, Kaiser JM, Avella D, Kimchi ET et al. Nanoliposomal ceramide prevents in vivo growth of hepatocellular carcinoma. Gut 2011; 60: 695–701.
(6)Haakenson JK, Khokhlatchev AV, Choi YJ, Linton SS, Zhang P, Zaki PM et al. Lysosomal degradation of CD44 mediates ceramide nanoliposome-induced anoikis and diminshed extravasation in metastatic carcinoma cells. J Biol Chem 2015; 290: 8632–8643.
(7)Ryland LK, Doshi UA, Shanmugavelandy SS, Fox TE, Aliaga C, Broeg K et al. C6-ceramide nanoliposomes target the Warburg effect in chronic lymphocytic leukemia. PLoS ONE 2013; 8: e84648.
Mark Kester 教授簡介

Mark Kester在紐約布法羅州立大學取得了博士學位,隨后進入伊利諾斯大學芝加哥分校進入博士后的研究。在完成博士后研究后,Mark Kester目前是美國弗吉尼亞大學醫學院教授。Kester博士的主要研究方向包括靶向藥物納米遞送技術。其技術獲得了廣泛的應用,Kester博士參與建立了采用其技術的多家公司。此外,由其作為共同作者所著并由Elsevier,Ltd.出版的《Integrated Pharmacology》被英國醫學會公認為“highly commended textbook”。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article
Ushma A Doshi, Jeremy Shaw, Todd E Fox, David F Claxton, Thomas P Loughran & Mark Kester. STAT3 mediates C6-ceramide-induced cell death in chronic lymphocytic leukemia. Signal Transduction and Targeted Therapy (2017) 2, e17051; doi:10.1038/sigtrans. 2017. 51
點擊“閱讀原文”可查看原文并免費下載PDF