美國加州大學洛杉磯分校(University of California, Los Angeles; UCLA)的Zhong Zheng教授、Kang Ting教授以及Chia Soo教授于2017年在自然出版社與四川大學華西醫院生物治療國家重點實驗室聯合主辦的期刊《Signal Transduction and Targeted Therapy》(STTT)上發表研究性論文:纖調蛋白聚糖(fibromodulin)通過誘發類似胚胎期細胞分子活動以減少成年皮膚瘢痕的形成。該研究結果提示纖調蛋白聚糖(fibromodulin)可有效減少皮膚瘢痕形成并提高創傷組織的抗拉強度。Zhong Zheng教授,Kang Ting教授和Chia Soo 教授為該文章的共同通訊作者,其中第一作者為Zhong Zheng教授。

與早期胚胎時期的無疤痕修復不同[1,2],晚期胚胎和成年個體的皮膚損傷會形成瘢痕,從而對患者造成嚴重的功能性和心理性的傷害。數據顯示,全球每年一億患者需進行瘢痕相關修復,其修復花費高達86億美元,然而,當前主要臨床療法對瘢痕的修復作用效果不佳或有嚴重副作用[3-5]。
纖調蛋白聚糖(fibromodulin)是一種廣泛存在于結締組織的細胞外基質[6],除了提供對細胞的機械支撐作用外,近期的研究表明,以纖調蛋白聚糖(fibromodulin)為代表的小型富亮氨酸蛋白聚糖(small leucine-rich proteoglycan)具有更廣泛的生物作用[7-13]。
通過十多年的研究,Zhong Zheng教授,Kang Ting教授和Chia Soo 教授的研究組發現纖調蛋白聚糖(fibromodulin)對于早期胚胎時期的無疤痕修復具有決定性作用[14-16],進而發現皮內注射纖調蛋白聚糖(fibromodulin)可以明顯改善成年小鼠、大鼠和豬皮膚損傷的外貌,減少瘢痕形成并提高創傷組織的抗拉強度(見圖1,圖2和圖3)。
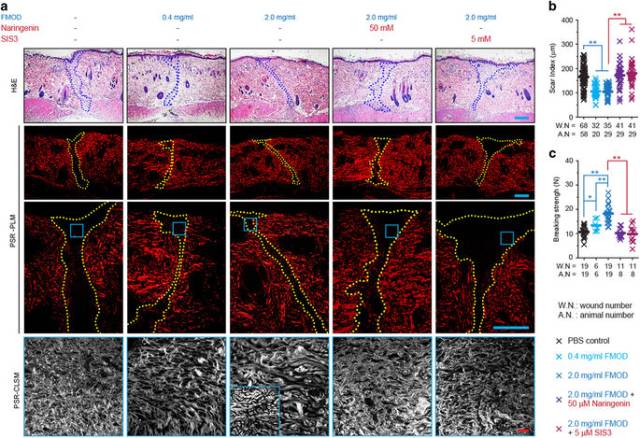
<圖1 FMOD reduced scar formation and increased wound tensile strength in adult rat cutaneous wounds.>
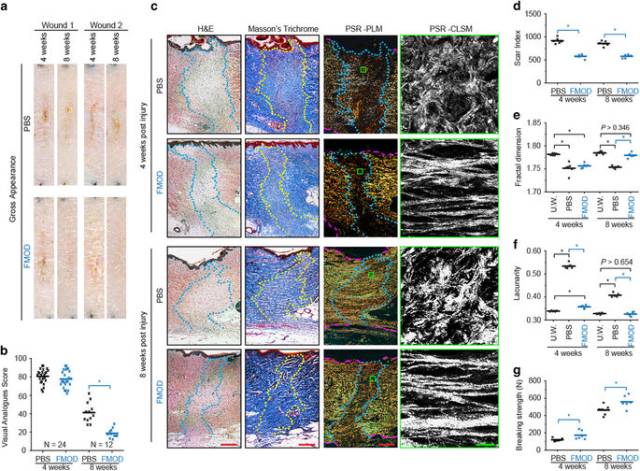
<圖2 FMOD reduced scar formation and increased wound tensile strength in adult Yorkshire pig cutaneous wounds.>
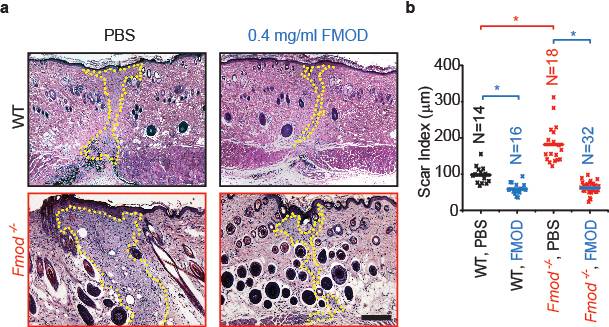
<圖3 FMOD administration reduced scar size in adult WT and Fmod-/- mouse cutaneous wounds.>
在隨后進行的機理性研究中,該團隊發現在成體細胞或組織中應用纖調蛋白聚糖(fibromodulin)一方面可以抑制轉移生長因子β1(transforming growth factor β1; TGFβ1)的自身表達,降低纖維化生長因子的合成,另一方面增強Smad2和Smad3信號傳導,提高結締組織生長因子(connective tissue growth factor; CTGF)的表達,促進真皮成纖維細胞(fibroblast)的遷移,以及加快成肌纖維細胞(myofibroblast)的成熟,收縮和凋亡,模擬出與早期胚胎時期的無疤痕修復相似的細胞分子行為,從而促進傷口的快速愈合,最終減少瘢痕的形成(見圖4,文章還有相關視頻,可點擊正文“閱讀原文”獲得)。
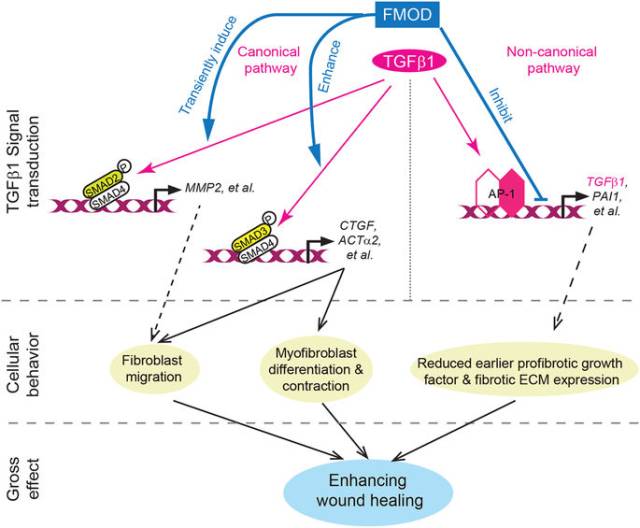
<圖4 FMOD delicately orchestrated TGFβ1-signaling during adult cutaneous wound healing.>
綜上,考慮到豬皮膚和人皮膚在解刨結構、機械性能和創傷修復動力學方面的高度相似性,該研究結果表明纖調蛋白聚糖(fibromodulin)及其生物制劑在抑制瘢痕形成和創傷修復中具有潛在的臨床應用價值,值得進一步研究。
參考文獻:
(1) Larson, B.J, Longaker, M.T. & Lorenz, H.P. Scarless fetal wound healing: a basic science review. Plast Reconstr Surg 126, 1172-1180 (2010).
(2) Rolfe, K.J. & Grobbelaar, A.O. A review of fetal scarless healing. ISRN dermatology 2012, 698034 (2012).
(3) Research, B. Markets for Advanced Wound Manage- ment Technologies. (BCC Research, Markets for Advanced Wound Management Technologies, 2014).
(4) Sund, B. & Arrow, A.K. New Developments in Wound Care, (Clinica reports, 2000).
(5) Gauglitz, G.G, Korting, H.C, Pavicic, T, Ruzicka, T. & Jeschke, M.G. Hypertrophic scarring and keloids: pathomechanisms and current and emerging treatment strategies. Mol Med 17, 113-125 (2011).
(6) Iozzo, R.V, Goldoni, S, Berendsen, A.D. & Young, M.F. Small Leucine-Rich Proteoglycans: The Extracellular Matrix: an Overview. (ed. Mecham, R.P.) 197-231 (Springer Berlin Heidelberg, 2011).
(7) Merline, R, Schaefer, R.M. & Schaefer, L. The matrice- llular functions of small leucine-rich proteoglycans (SLRPs). J Cell Commun Signal 3, 323-335 (2009).
(8) Schaefer, L. & Schaefer, R.M. Proteoglycans: from structural compounds to signaling molecules. Cell and tissue research 339, 237-246 (2010).
(9) Zheng, Z, et al. Reprogramming of human fibroblats into multipotent cells with a single ECM proteoglycan, fibromodulin. Biomaterials 33, 5821-5831 (2012).
(10) Jian, J, et al. Fibromodulin promoted in vitro and in vivo angiogenesis. Biochemical and Biophysical Research Communication 436, 537 - 542 (2013).
(11) Adini, I, et al. Melanocyte-secreted fibromodulin promotes an angiogenic microenvironment. Journal Of Clinical Investigation 124, 425-436 (2014).
(12) Zheng, Z, et al. Fibromodulin Enhances Angiogenesis during Cutaneous Wound Healing. Plastic and reconstructive surgery. Global open 2, e275 (2014).
(13) Li, C.S, et al. Fibromodulin reprogrammed cells: A novel cell source for bone regeneration. Biomaterials 83, 194-206 (2016).
(14) Soo, C, et al. Differential expression of fibromodulin, a transforming growth factor-beta modulator, in fetal skin development and scarless repair. Am J Pathol 157, 423-433 (2000).
(15) Soo, C, Beanes, S, Dang, C, Zhang, X. & Ting, K. Fibromodulin, a TGF-? modulator, promotes scarless fetal repair. Surgical Forum 578-581 (2001).
(16) Zheng, Z., et al. Fibromodulin is essential for fetal-type scarless cutanous wound healing. American Journal of Pathology 186, 2824-2832 (2016).
Zhong Zheng 教授簡介

Zhong Zheng教授于清華大學先后取得學士、碩士和博士學位,畢業后先后在美國南加州大學(University of Southern California)和美國加州大學洛杉磯分校從事創傷修復的研究,目前擔任加州大學洛杉磯分校的助理教授。Zheng教授目前已發表40余篇SCI論文,涉及創傷修復,生物材料,組織工程,納米材料,骨骼及軟骨發育及修復,抗感染材料等方面。
Kang Ting 教授簡介

Kang Ting教授,美國加州大學洛杉磯分校(UCLA)牙學院正畸及生長發育科主任,畢業于哈佛大學牙學院并取得牙科博士學位。Ting教授研究方向主要有皮膚及骨組織再生,骨骼及軟骨發育及修復等,經過數十年研究,Ting教授在創傷修復領域取得突破,多次獲得美國NIH基金并發表40余篇SCI論文。
Chia Soo 教授簡介

Chia Soo教授,畢業于美國加州大學洛杉磯分校,為美國整形外科委員會成員,曾在美國加州大學從事創傷修復研究,目前于加州大學洛杉磯分校David Geffen醫學院擔任教授。Soo教授研究領域著重于使用組織工程技術研究骨組織及皮膚再生及修復并在該領域內發表數十篇SCI論文。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature. com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
實驗室網站:http://labs.wpi.edu/dempskilab/
Cite this article
Zhong Zheng, Aaron W James, Chenshuang Li, Wenlu Jiang, Joyce Z Wang, Grace X Chang, Kevin S Lee, Feng Chen, Emily A Berthiaume, Yao Chen, Hsin Chuan Pan, Eric C Chen, Weiming Li, Zhihe Zhao, Xinli Zhang, Kang Ting & Chia Soo. Fibromodulin reduces scar formation in adult cutaneous wounds by eliciting a fetal-like phenotype. Signal Transduction and Targeted Therapy (2017) 2, e17050; doi:10.1038/sigtrans.2017.50
點擊“閱讀原文”可查看原文并免費下載PDF