四川大學楊金亮教授團隊在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了研究性文章,設計的以單鏈-白蛋白融合抗體為導向分子的新型ADCs能夠有效的抑制HER2陽性腫瘤的生長,楊金亮教授是該文的通訊作者,張航博士為第一作者。

HER-2(Human epidermal growth factor receptor-2)為具有酪氨酸激酶活性的跨膜受體樣蛋白。HER2的活化能誘導細胞的增殖、分化和遷移,也參與了細胞的抗凋亡機制。 HER2 在正常組織中不表達或者表達量極低,而在乳腺癌、胃癌、卵巢癌、前列腺癌和結腸癌等多種惡性腫瘤中過表達,已經成為重要的腫瘤治療靶點。
已上市的 HER2靶向治療藥物主要分為抗體類藥物和小分子抑制劑。抗體類藥物包括 Trastuzumab、Pertuzumab和T-DM1。 Trastuzumab的適應癥為HER2陽性的轉移性乳腺癌和胃癌,其余兩種都只用于HER2陽性轉移性乳腺癌的治療。小分子酪氨酸激酶抑制劑Lapatinib的適應癥為接受過Trastuzumab治療的HER2陽性轉移性乳腺癌。靶向EGFR、HER2和HER4的小分子抑制劑Afatinib用于治療EGFR Del19或L858R突變型非小細胞肺癌。
抗體偶聯藥物(antibody-drug conjugates, ADCs) 由單克隆抗體、 高效應的細胞毒性物質以及連接臂三部分組成,它將抗體的靶向性與小分子化合物細胞殺傷活性高的特點相合, 可以提高腫瘤治療的選擇性,降低抗腫瘤藥物的不良反應,還能更好地應對靶向單抗的耐藥性問題。因此,ADCs目前已成為抗腫瘤抗體藥物研發的新熱點和重要趨勢,受到越來越多的關注。T-DM1是一種治療HER2 陽性轉移性乳腺癌的ADCs,但是在III期臨床試驗中,T-DM1單藥治療的中位無進展生存期為6.4個月,與傳統的化學藥物治療相比只延長了3.2個月。全抗分子量較大,實體組織穿透性較差,限制了T-DM1在實體腫瘤中的治療效果。Fab、單鏈抗體(scFv)和diabody等工程抗體與全抗相比具有相似的結合活性,但因其分子小,具有良好的血管和組織穿透性,作為ADCs的導向載體可能增加其療效。但是單鏈抗體在血漿中的半衰期較短,這成為其在臨床應用上的缺陷。人血清白蛋白(Human serum albumin, HSA) 是主要的血漿蛋白之一,為理想的藥物傳遞載體。由于白蛋白易于在惡性和炎性的組織中聚集,因此也具有一定的腫瘤靶向性。以白蛋白融合單鏈抗體作為 ADCs 的導向載體,在增加了藥物半衰期的同時也可在一定程度上增加其腫瘤靶向性,為 ADCs 研發的新方向。
在此次研究中,楊金亮教授的團隊設計并通過哺乳動物細胞瞬時表達系統制備了兩種靶向HER2的單鏈-白蛋白融合抗體(scFv-HSA融合抗體)T-SA1和T-SA2。進一步對抗體的靶向性、親和力、內化效率和體內分布進行了研究。研究表明,融合抗體能夠特異性地靶向HER2陽性細胞,具備高親和活性,可有效內化至細胞并進入溶酶體降解途徑。而且,該新型抗體較現有的單克隆抗體而言具有更優的體內靶向性和腫瘤組織穿透能力,是一種非常有潛力的導向載體。
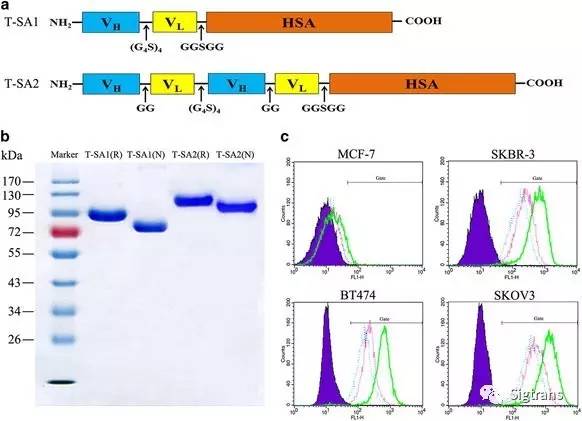
在確定制備的單鏈-白蛋白融合抗體適宜于作為ADCs的導向載體后,通過對緩沖鹽成分、pH、鹽濃度、反應時間、抗體濃度和投料比等因素的反復摸索,建立了穩定可行的與美登素衍生物DM1偶聯的方案。美登素(Maytansine)從非洲灌木美登木(Maytenus ovatus)的樹皮中分離得到,通過與微管蛋白的長春花位點結合抑制微管蛋白聚集,從而促進腫瘤細胞凋亡。DM1為美登素衍生物,具有良好的細胞殺傷活性,為常用的 ADCs 的效應分子之一。制備的scFv-HSA-DM1偶聯物(T-SA1-DM1和T-SA2-DM1)與原抗體相比有著相同的體外細胞靶向性和親和活性。體內外抗腫瘤活性研究表明,scFv-HSA-DM1偶聯物能有效抑制HER2陽性腫瘤細胞的生長,并且在體內實驗中表現出了顯著的抗腫瘤能力,其中T-SA1-DM1可導致部分免疫缺陷小鼠體內產生的移植瘤消退。
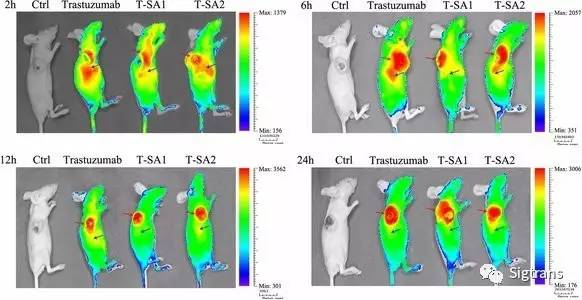
綜上,楊金亮教授的團隊設計并制備了由scFv-HSA融合抗體與美登素衍生物DM1偶聯而成的ADC。這種藥物可以靶向HER2陽性腫瘤,具有靶向性強、親和活性高、實體瘤組織穿透性好以及體內外抗腫瘤活性顯著等特點。該研究為抗HER2陽性腫瘤ADCs的研發奠定了基礎,具有進一步研究的意義。
參考文獻:
(1)Flemming A. Antibody engineering: fine-tuning antibody-drug conjugates. Nat Rev Drug Discov 2014; 13: 178–178.
(2) Crunkhorn S. Drug design: increasing stability of ADCs. Nat Rev Drug Discov 2014; 13: 812–812.
楊金亮教授簡介

楊金亮,四川大學華西醫院生物治療國家重點實驗室教授,基因工程抗體研究室主任。主要研究方向為腫瘤細胞生物學、抗體藥物研發、腫瘤免疫基因治療和蛋白質組學。近年來,以通訊作者身份在Nature Communication、Angew. Chem. Int. Ed.、J Control Release、Molecular Pharmacology等雜志上發表SCI論文60余篇。獲得授權發明專利6項。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature.com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授/院士擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article Hang Zhang, Yuxi Wang, Yangping Wu, Xiaohua Jiang, Yiran Tao, Yuqin Yao, Yujia Peng, Xiangzheng Chen, Yuyin Fu, Lin Yu, Ruixue Wang, Qinhuai Lai, Weirong Lai, Wenting Li, Yuhuan Kang, Shuli Yi, Ying Lu, Lantu Gou, Min Wu & Jinliang Yang. Therapeutic potential of an anti-HER2 single chain antibody–DM1 conjugates for the treatment of HER2-positive cancer. Signal Transduction and Targeted Therapy (2017) 2, e17015; doi:10.1038/sigtrans.2017.15
點擊下方“閱讀原文”可查看原文并免費下載PDF