軍事醫學科學院的張令強教授團隊在自然出版社與川大華西醫院生物治療國家重點實驗室聯合主辦的 《Signal Transduction and Targeted Therapy》(STTT)上發表了有關Nanog去泛素化的酶的研究(http://www.nature.com/articles/sigtrans 201624,閱讀原文及下載PDF可直接點擊本文最下方“閱讀原文”)。 STTT對該成果進行快速發表,審稿僅用一周,從接收投稿到在線發表僅用一個月。
胚胎干細胞和誘導多功能干細胞具有自我更新和分化成多種細胞的能力,胚胎干細胞的多能性由一系列核心轉錄因子控制,例如Nanog,Oct4和Sox2。已知這些調節胚胎干細胞的多能性的轉錄因子,科學家可以通過控制這些轉錄因子的組合表達產生人誘導的多功能干細胞。
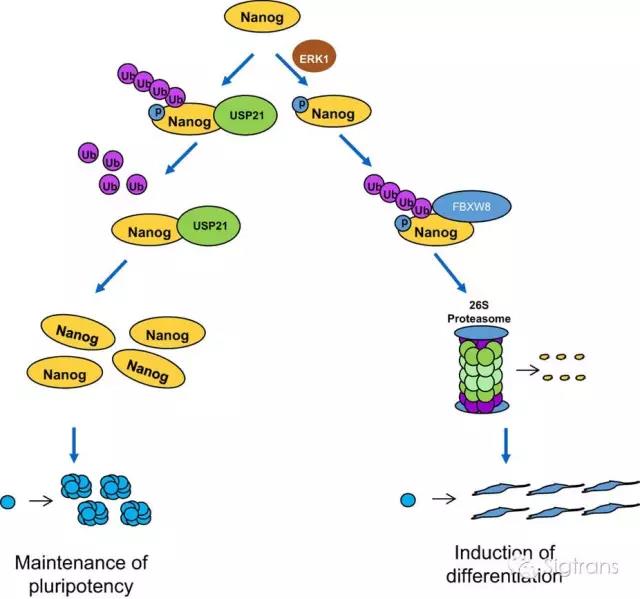
Nanog作為干細胞干性和維持自我更新的一個重要的轉錄因子,其高表達有助于維持干細胞多能性和自我更新,若其表達水平降低就會促進干細胞的分化。已有研究表明,Nanog的穩定性的維持同時受泛素化和去泛素化的調控,如泛素連接酶FBXW8可以促進Nanog的泛素化降解進而誘導細胞分化。然而促進 Nanog去泛素化并維持其穩定性的酶一直未見報道。
來自軍事醫學科學院放射與輻射醫學研究所的張令強教授團隊篩選了32個去泛素化酶,并最終找到了促進Nanog去泛素化的酶 —— USP21。USP21可通過去泛素化作用維持Nanog的蛋白表達水平,從而維持干細胞的多能性。Nanog的泛素化修飾需要一個前提條件,就是ERK1催化的磷酸化,這被稱之為磷酸化驅動的泛素化,即先有磷酸化再有泛素化,最后導致Nanog被降解。但USP21去泛素化修飾無需磷酸化修飾。
文章同時還報道了在小鼠的胚胎干細胞分化過程中,USP21的水平有一個從高到低的下調過程,伴隨著Nanog的顯著下調,與此同時,另一些干細胞的標志物,如oct4和 sox2的表達,也發生了下調。
綜上所述,這項研究發現并確定了USP21與Nanog的相互作用,發現USP21是Nanog的特異性去泛素化酶, 可通過去泛素化作用來穩定Nanog,進而維持小鼠胚胎干細胞的多能性和自我更新。此外,USP21的耗竭還會引起小鼠胚胎干細胞的分化。該研究發現了USP21在干細胞命運中的重要作用。對于進一步認識干細胞分化信號通路具有重要意義。
Signal Transduction and Targeted Therapy簡介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集團和四川大學華西醫院生物治療國家重點實驗室合作出版的全英文生物醫學專業期刊(網站:http://www.nature.com/sigtrans,點擊本網站最下方"閱讀原文”)。主編由美國俄亥俄州立大學Carlo M. Croce教授(美國三院院士,Cancer Research前主編),UCSD的張康教授、川大華西醫院魏于全教授擔任。有來自全球等多個國家及地區的多位相關領域的近百位著名學者組成編委會。本雜志每周五發表文章,歡迎各位投稿,包括論著或綜述。對于原創性成果采取“快速通道”模式,幫助作者以最快的速度發表文章,最快一周可接收。該雜志發表論文可免收發表費。該雜志投稿格式不限,正式發表之前再按雜志格式修改。感謝將此信息轉發給您們的同事、朋友以及學生等。
Cite this article Xingyu Liu, Yuying Yao, Huiguo Ding, Chuanchun Han, Yuhan Chen, Yuan Zhang, Chanjuan Wang, Xin Zhang, Yiling Zhang, Yun Zhai, Ping Wang, Wenyi Wei, Jing Zhang & Lingqiang Zhang.USP21 deubiquitylates Nanog to regulate protein stability and stem cell pluripotency.Signal transduction and targeted therapy,1. (2016). doi:10.1038/sigtrans.2016.24
點擊下方“閱讀原文”可查看原文并免費下載PDF