主動脈瓣疾病是心臟外科最常見的病種之一,胸骨正中切口主動脈瓣置換術(aortic valve replacement,AVR)因其手術視野顯露清楚、操作方便、安全性高、近遠期手術療效可靠等優點而成為主動脈瓣病變最經典的手術方式。隨著微創外科技術的發展,微創主動脈瓣置換術(minimally invasive aortic valve replacement,MI-AVR)逐漸成熟,胸骨上段小切口(ministernotomy,MS)和右側肋間小切口(minithoracotomy,MT)是目前最常見的兩種MI-AVR入路[1]。MI-AVR具備了創傷小、恢復快、住院時間短等優勢,但因術野小,顯露較差,常規人工瓣膜縫合打結操作難度顯著增加,導致MI-AVR術中體外循環時間和主動脈阻斷時間等較傳統AVR明顯延長[1]。Perceval免縫合生物瓣(Corcym,意大利)是一種由牛心包瓣葉和自擴式鎳鈦合金支架組成的人工生物瓣膜。在植入時,首先使用無創傷壓縮裝置使瓣膜收縮,確保瓣葉不受影響,然后在瓣環水平定位后釋放。其類似于經導管介入瓣膜的自擴式錨定的植入方式,無需進行瓣環和人工瓣膜的縫合打結,在保留切除病變瓣膜優勢的同時改變人工瓣膜植入方法,有效縮短了手術時間[2]。因此,Perceval免縫合生物瓣的應用有助于降低MI-AVR圍術期風險,同時推動該術式的發展和推廣。自2007年首次應用于人體以來,越來越多的高質量研究[2-4]證實其安全性和有效性,但目前國內尚未見類似文獻報道。本文旨在通過收集Perceval免縫合生物瓣在MI-AVR中成功應用病例的臨床資料,分析和評價Perceval免縫合生物瓣在MI-AVR中應用的安全性和臨床療效。
1 資料與方法
1.1 臨床資料
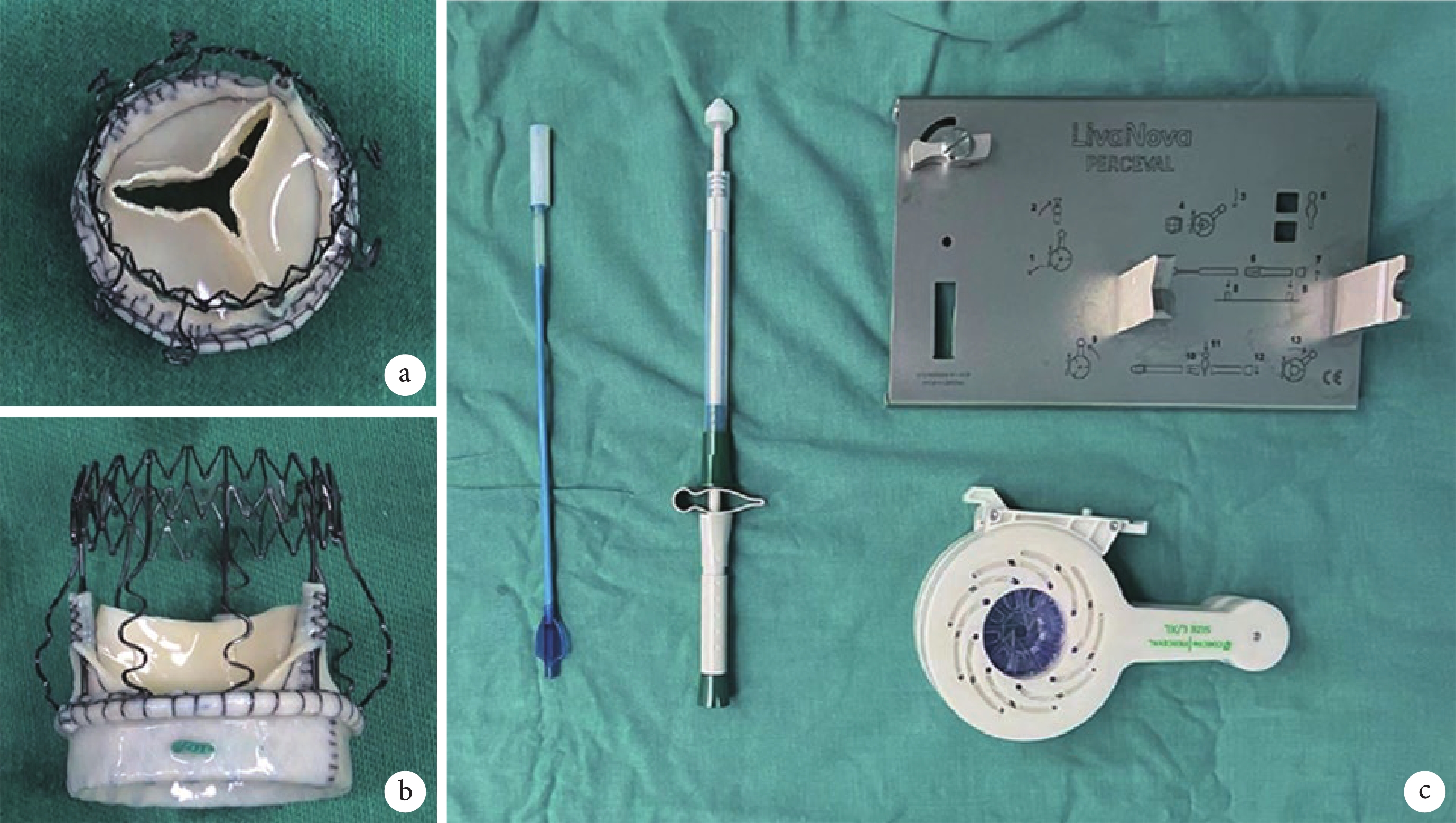
連續納入2022年3—11月四川大學華西醫院心臟大血管外科收治的單純主動脈瓣疾病患者,術前常規完善超聲心動圖、12導聯心電圖、冠狀動脈造影、多層螺旋 CT 血管成像(computed tomography angiography,CTA)及實驗室檢查。根據患者主動脈瓣病變和解剖特點應用Perceval免縫合生物瓣(圖1)分別行MS-AVR或MT-AVR,記錄患者的圍術期臨床資料。
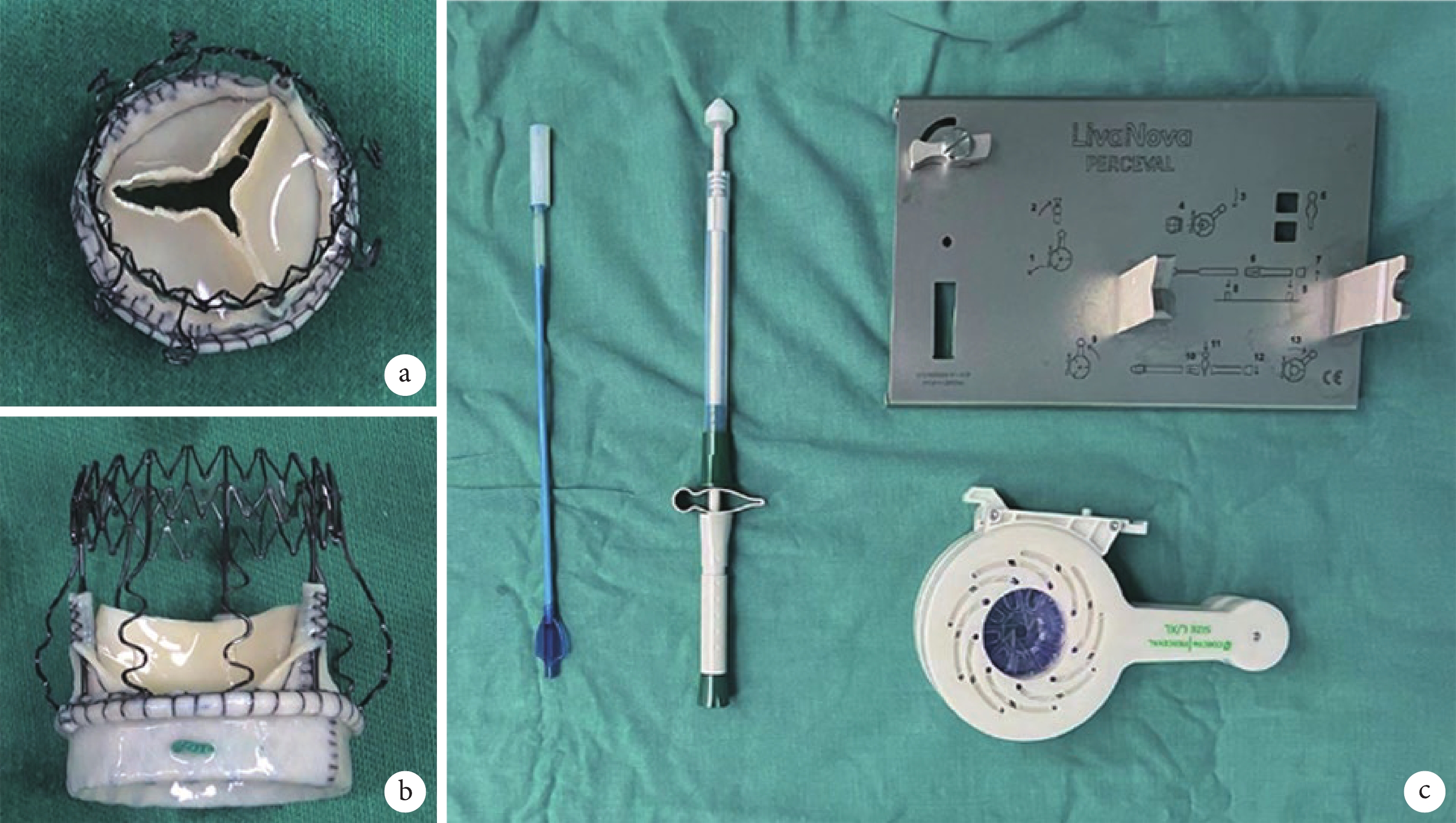 圖1
Perceval免縫合生物瓣和壓瓣裝置
圖1
Perceval免縫合生物瓣和壓瓣裝置
a~b:Perceval免縫合生物瓣;c:壓瓣裝置
1.2 手術方法
手術方法分為MS-AVR和MT-AVR,兩種方法均在體外循環下進行。MS-AVR術中動態監測有創血壓,全身麻醉后氣管插管,常規行頸內靜脈置管,放置體外除顫電極和經食管超聲心動圖(transesophageal echocardiography,TEE)探頭等。患者取仰臥位,沿胸骨中線自第2肋至第4肋作一切口,“J”型或反“L”型鋸開胸骨(圖2a~b),切開并懸吊心包顯露升主動脈。MT-AVR術中動態監測有創血壓,全身麻醉后行雙腔氣管插管,以便術中左肺單肺通氣,左側頸內靜脈置管建立靜脈通道,右側頸內靜脈留置鞘管備用。常規放置體外除顫電極和TEE探頭等。患者取仰臥位,右側墊高約20°~30°,根據術前CTA三維重建評估升主動脈和胸廓肋間隙關系后選擇第2或第3肋間作為手術入路(圖2c~d)。沿肋間隙走行距胸骨右緣1~1.5 cm作一手術切口,內側角剛好對應于右乳內動脈體表投影,切開心包并懸吊,充分顯露升主動脈。
 圖2
術后手術切口
圖2
術后手術切口
a~b胸骨上段小切口;c~d:肋間小切口
全身肝素化,TEE引導下常規行股動靜脈插管建立體外循環。阻斷升主動脈,灌入高鉀心臟停跳液后心臟停跳。橫行切開升主動脈,如合并升主動脈瘤樣擴張需同期行升主動脈成形時則縱行切開升主動脈,切口下緣距瓣環平面≥3.5 cm,充分顯露主動脈瓣(圖3a)。切除病變瓣膜并仔細清除瓣環鈣化。參照Perceval免縫合主動脈瓣標準使用流程[5],采用專用測瓣器測量主動脈瓣環徑(圖3b~c),根據測量結果選擇合適型號Perceval 免縫合生物瓣并壓瓣(圖3d)。用3-0 prolene線在主動脈瓣環均勻縫制3針引導線(圖3e),植入免縫合主動脈瓣膜,采用“Snugger method”固定人工生物瓣并反復確認瓣膜與瓣環位置[6](圖3f~g)。釋放人工生物瓣膜,撤除引導線并采用專用球囊進行瓣環擴張(圖3h~i)。關閉升主動脈切口,預防性縫制心外膜臨時起搏導線后開放升主動脈,心臟復跳,輔助循環直至停機。TEE評估人工瓣膜功能并測量血流動力學指標確認瓣膜功能無異常后逐層關閉手術切口。
 圖3
Perceval免縫合生物瓣植入過程
圖3
Perceval免縫合生物瓣植入過程
a:充分顯露主動脈瓣;b~c:測量瓣環徑,確定瓣膜型號;d:壓瓣;e:縫制3針引導線;f:引導線一一對應穿過人工瓣膜上3個縫合環;g:“Snugger methods”固定人工瓣膜于主動脈瓣環;h:釋放瓣膜后球囊擴張人工瓣膜瓣環水平;i:撤除3針引導線
1.3 術后管理與隨訪
患者術后常規入ICU繼續治療,待病情平穩后轉回普通病房直至康復出院。記錄術后24 h引流量、輸血量、住ICU和總住院時間、腦卒中、房室傳導阻滯等圍術期并發癥發生情況,收集出院前心臟彩色超聲(彩超)、心電圖等檢查結果。術后規律華法林抗凝治療3個月,維持INR為1.5~2.0,動態監測凝血功能,術后3個月和1年常規復查心臟彩超和心電圖。
1.4 倫理審查
本研究已通過四川大學華西醫院生物醫學倫理中心審批,批準號:2022年審(995)號。
2 結果
共納入5例患者,其中女3例、男2例,平均年齡71歲,患者術前基礎資料見表1。所有患者均成功植入Perceval免縫合生物瓣,其中2例患者同期行升主動脈成形術,手術成功率100%。經MS和MT入路分別為3例和2例,術中體外循環時間、主動脈阻斷時間、術后TEE測量最大前向血流速度、平均跨瓣壓差和術后ICU住院時間、24h引流量等臨床數據統計見表2。所有患者術中平均轉機時間為61 min,平均主動脈阻斷時間為32.2 mmin,較傳統正中開胸AVR時間明顯縮短,且術后24 h引流量明顯減少,住ICU時間亦有所縮短。所有納入患者術后恢復順利,無瓣周漏、房室傳導阻滯、腦卒中等并發癥發生;見表2。
術后3個月隨訪時生存率100%,所有患者均無心累、氣促、胸痛等癥狀,無房室傳導阻滯、人工瓣膜感染、瓣周漏、腦梗等并發癥發生,紐約心臟協會心功能Ⅰ~Ⅱ級。經胸超聲心動圖示人工瓣膜功能正常,無瓣周漏,血流動力學參數較術后早期無明顯變化,心電圖示竇性心律。
3 討論
AVR是主動脈瓣疾病最有效的治療方法[7]。自1964年首次報道以來,傳統胸部正中切口胸骨全開入路是近半個多世紀AVR手術的經典入路,具有手術視野顯露清楚、操作方便、安全性高、近遠期手術療效可靠等優點。近年來,主動脈瓣病變的治療越來越集中于發展和普及微創手術。隨著MI-AVR和經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)的逐步發展,主動脈瓣病變的外科治療進入微創化時代。
MI-AVR包括MS和MT兩種入路,其中MS是使用最廣泛的方法,MT-AVR往往需要胸腔鏡輔助,操作難度更大,故臨床應用相對更少,但因不損傷骨骼,手術創傷更小、恢復更快。與傳統正中完全開胸AVR相比較,MI-AVR在降低術后并發癥發生率和輸血需求、縮短術后住院時間以及患者滿意度等方面具有更好的臨床結果[8]。盡管既往研究[9-10]顯示MI-AVR與傳統AVR圍術期并發癥發生率和遠期臨床結局差異無統計學意義。但令人意外的是,目前臨床上MI-AVR并未得到廣泛推廣,大部分體外循環下AVR仍然是采用胸骨正中全開的手術方式[1]。這一現象可能與MI-AVR術野較小,顯露困難,增加了術中操作難度,整體手術時間和術中體外循環時間、主動脈阻斷時間均長于傳統胸骨全開AVR有關。免縫合或快速釋放主動脈瓣置換(sutureless and rapid-deployment aortic valve replacement,SURD-AVR)的應用簡化了瓣膜植入方式,省去了術中瓣膜縫合和打結的時間,有助于促進MI-AVR的開展和推廣。
當前臨床中應用的SURD-AVR生物瓣種類包括Perceval S(Corcym,意大利),Edwards Intuity/Intuity Elite(Edwards Lifesciences,美國)和Enable 3F(Medtronic,美國)。其中Edwards Intuity/Intuity Elite和Enable 3F需要在釋放之后將引導線打結,屬于快速釋放生物瓣,只有Perceval S在釋放之后撤除引導線,無需打結,真正實現了免縫合[11]。2018年SURD-AVR國際注冊中心報道了超過3 300例患者SURD-AVR術后的早期臨床結局,結果顯示SURD-AVR是一種可有效替代傳統AVR的手術方法,且有助于促進手術入路微創化,推動MI-AVR的開展和推廣[3]。Szecel等[4]報道了2007—2017年連續納入的468例應用Perceval免縫合生物瓣患者的中期臨床結局,結果顯示人工瓣膜血流動力學良好,無患者因結構性瓣膜退變而再次手術。這一結果充分肯定了Perceval免縫合生物瓣臨床應用的安全性和有效性。另一方面,Fujita等研究發現高達75%的免縫合生物瓣應用于MI-AVR,這一結果充分證實了Perceval免縫合生物瓣在MI-AVR中應用的顯著優勢。Perceval免縫合生物瓣通過簡化的植入方法縮短手術時間彌補了MI-AVR最主要的局限性,Fujita等[12]甚至認為MI-AVR是免縫合生物瓣的首要適應證。
另一方面,TAVR提供了一種全新的人工瓣膜植入方法,且已經取得了較大進展和良好的近中期臨床結果。微創是TAVR的獨特優勢,患者可以避免體外循環,減少輸血量,術后恢復快,住院時間短[13],因此,TAVR已成為高齡高危單純主動脈瓣疾病患者的首選治療方法。隨著TAVR的安全性和可靠性不斷得到證實,其適用范圍不斷擴大,目前對于中低危的高齡患者亦是一種有效的治療選擇[14]。然而,TAVR保留了病變瓣膜,導致其無法適用于如感染性心內膜炎等部分特殊主動脈瓣病變患者。其次,保留嚴重鈣化的瓣葉和瓣環,可能增加TAVR圍術期瓣周漏、腦梗塞和瓣口梗阻等不良事件發生風險和降低人工瓣膜耐久性[15-16]。
瓣周漏是TAVR和免縫合主動脈瓣置換最常見的圍術期不良事件之一,但TAVR發生風險顯著高于免縫合主動脈瓣置換。其主要原因可歸因于MI-AVR術中可切除病變瓣膜,并清除瓣環鈣化,從而降低瓣周漏發生風險。Chung等[17]發現TVAR術后輕中度瓣周漏發生率高達59.7%,而免縫合主動瓣置換瓣周漏發生率僅約8.1%。Okuno等[18]在5年隨訪中發現即使是輕微的瓣周漏也可能是影響長期生存率的風險因素。我們不難發現雖然Chung等[17]的研究結果顯示免縫合主動脈瓣置換術后致命性出血、急性腎損傷、新發心房顫動發生率以及住ICU和總住院時間均高于或長于TVAR,但術后30 d死亡率差異無統計學意義,而術后1年死亡率卻低于TAVR[17]。2022年美國胸外科協會年會報道一項納入2 133例重度主動脈瓣狹窄患者的歐洲多中心研究,經過傾向性評分匹配后研究結果顯示,免縫合組瓣周漏發生率顯著低于TAVR組(0.97% vs. 4.84%,P<0.001),術后9年全因死亡率(36.7% vs.41.8%,P=0.023)和心源性死亡率(10.1% vs. 19.5%,P<0.001)均低于TAVR組。因此,部分學者認為TAVR中遠期死亡率升高的主要原因為TAVR術后瓣周漏發生率明顯高于免縫合AVR。此外,免縫合AVR圍術期永久起搏器植入、腦卒中等并發癥發生率亦低于TAVR[19-21]。免縫合AVR中可直視下切除病變瓣膜,清除鈣化,從而可降低術中鈣化組織脫落導致周圍性栓塞事件發生的風險。同時直視下可準確測量瓣環大小,選擇最佳型號瓣膜,避免人工瓣膜瓣環直徑放大率過大,有助于人工瓣膜釋放過程中精確定位瓣環和保持人工瓣膜與瓣環同軸性,減少對傳導束的影響[22]。
總之,Perceval免縫合生物瓣應用于MI-AVR,最大程度兼顧了微創、圍術期安全性和可靠的遠期療效,為患者提供了一種新的手術治療選擇,具有較好的臨床應用前景。尤其適用于二葉式主動脈瓣畸形、感染性心內膜炎、嚴重瓣膜鈣化和合并其他心臟瓣膜或主動脈病變的高齡患者。在臨床實踐中術前需仔細評估患者主動脈瓣病變和解剖條件,嚴格把握手術指征,并在具備一定微創手術經驗的中心開展此類手術。
利益沖突:無。
作者貢獻:楊鵬負責文章撰寫和修改;劉宇、郎乾鐳和謝毅參與資料收集與術中錄像;李雯帆和王晨昊參與文獻檢索和整理;胡佳對文章的相關內容進行指導和修正。
主動脈瓣疾病是心臟外科最常見的病種之一,胸骨正中切口主動脈瓣置換術(aortic valve replacement,AVR)因其手術視野顯露清楚、操作方便、安全性高、近遠期手術療效可靠等優點而成為主動脈瓣病變最經典的手術方式。隨著微創外科技術的發展,微創主動脈瓣置換術(minimally invasive aortic valve replacement,MI-AVR)逐漸成熟,胸骨上段小切口(ministernotomy,MS)和右側肋間小切口(minithoracotomy,MT)是目前最常見的兩種MI-AVR入路[1]。MI-AVR具備了創傷小、恢復快、住院時間短等優勢,但因術野小,顯露較差,常規人工瓣膜縫合打結操作難度顯著增加,導致MI-AVR術中體外循環時間和主動脈阻斷時間等較傳統AVR明顯延長[1]。Perceval免縫合生物瓣(Corcym,意大利)是一種由牛心包瓣葉和自擴式鎳鈦合金支架組成的人工生物瓣膜。在植入時,首先使用無創傷壓縮裝置使瓣膜收縮,確保瓣葉不受影響,然后在瓣環水平定位后釋放。其類似于經導管介入瓣膜的自擴式錨定的植入方式,無需進行瓣環和人工瓣膜的縫合打結,在保留切除病變瓣膜優勢的同時改變人工瓣膜植入方法,有效縮短了手術時間[2]。因此,Perceval免縫合生物瓣的應用有助于降低MI-AVR圍術期風險,同時推動該術式的發展和推廣。自2007年首次應用于人體以來,越來越多的高質量研究[2-4]證實其安全性和有效性,但目前國內尚未見類似文獻報道。本文旨在通過收集Perceval免縫合生物瓣在MI-AVR中成功應用病例的臨床資料,分析和評價Perceval免縫合生物瓣在MI-AVR中應用的安全性和臨床療效。
1 資料與方法
1.1 臨床資料
連續納入2022年3—11月四川大學華西醫院心臟大血管外科收治的單純主動脈瓣疾病患者,術前常規完善超聲心動圖、12導聯心電圖、冠狀動脈造影、多層螺旋 CT 血管成像(computed tomography angiography,CTA)及實驗室檢查。根據患者主動脈瓣病變和解剖特點應用Perceval免縫合生物瓣(圖1)分別行MS-AVR或MT-AVR,記錄患者的圍術期臨床資料。
 圖1
Perceval免縫合生物瓣和壓瓣裝置
圖1
Perceval免縫合生物瓣和壓瓣裝置
a~b:Perceval免縫合生物瓣;c:壓瓣裝置
1.2 手術方法
手術方法分為MS-AVR和MT-AVR,兩種方法均在體外循環下進行。MS-AVR術中動態監測有創血壓,全身麻醉后氣管插管,常規行頸內靜脈置管,放置體外除顫電極和經食管超聲心動圖(transesophageal echocardiography,TEE)探頭等。患者取仰臥位,沿胸骨中線自第2肋至第4肋作一切口,“J”型或反“L”型鋸開胸骨(圖2a~b),切開并懸吊心包顯露升主動脈。MT-AVR術中動態監測有創血壓,全身麻醉后行雙腔氣管插管,以便術中左肺單肺通氣,左側頸內靜脈置管建立靜脈通道,右側頸內靜脈留置鞘管備用。常規放置體外除顫電極和TEE探頭等。患者取仰臥位,右側墊高約20°~30°,根據術前CTA三維重建評估升主動脈和胸廓肋間隙關系后選擇第2或第3肋間作為手術入路(圖2c~d)。沿肋間隙走行距胸骨右緣1~1.5 cm作一手術切口,內側角剛好對應于右乳內動脈體表投影,切開心包并懸吊,充分顯露升主動脈。
 圖2
術后手術切口
圖2
術后手術切口
a~b胸骨上段小切口;c~d:肋間小切口
全身肝素化,TEE引導下常規行股動靜脈插管建立體外循環。阻斷升主動脈,灌入高鉀心臟停跳液后心臟停跳。橫行切開升主動脈,如合并升主動脈瘤樣擴張需同期行升主動脈成形時則縱行切開升主動脈,切口下緣距瓣環平面≥3.5 cm,充分顯露主動脈瓣(圖3a)。切除病變瓣膜并仔細清除瓣環鈣化。參照Perceval免縫合主動脈瓣標準使用流程[5],采用專用測瓣器測量主動脈瓣環徑(圖3b~c),根據測量結果選擇合適型號Perceval 免縫合生物瓣并壓瓣(圖3d)。用3-0 prolene線在主動脈瓣環均勻縫制3針引導線(圖3e),植入免縫合主動脈瓣膜,采用“Snugger method”固定人工生物瓣并反復確認瓣膜與瓣環位置[6](圖3f~g)。釋放人工生物瓣膜,撤除引導線并采用專用球囊進行瓣環擴張(圖3h~i)。關閉升主動脈切口,預防性縫制心外膜臨時起搏導線后開放升主動脈,心臟復跳,輔助循環直至停機。TEE評估人工瓣膜功能并測量血流動力學指標確認瓣膜功能無異常后逐層關閉手術切口。
 圖3
Perceval免縫合生物瓣植入過程
圖3
Perceval免縫合生物瓣植入過程
a:充分顯露主動脈瓣;b~c:測量瓣環徑,確定瓣膜型號;d:壓瓣;e:縫制3針引導線;f:引導線一一對應穿過人工瓣膜上3個縫合環;g:“Snugger methods”固定人工瓣膜于主動脈瓣環;h:釋放瓣膜后球囊擴張人工瓣膜瓣環水平;i:撤除3針引導線
1.3 術后管理與隨訪
患者術后常規入ICU繼續治療,待病情平穩后轉回普通病房直至康復出院。記錄術后24 h引流量、輸血量、住ICU和總住院時間、腦卒中、房室傳導阻滯等圍術期并發癥發生情況,收集出院前心臟彩色超聲(彩超)、心電圖等檢查結果。術后規律華法林抗凝治療3個月,維持INR為1.5~2.0,動態監測凝血功能,術后3個月和1年常規復查心臟彩超和心電圖。
1.4 倫理審查
本研究已通過四川大學華西醫院生物醫學倫理中心審批,批準號:2022年審(995)號。
2 結果
共納入5例患者,其中女3例、男2例,平均年齡71歲,患者術前基礎資料見表1。所有患者均成功植入Perceval免縫合生物瓣,其中2例患者同期行升主動脈成形術,手術成功率100%。經MS和MT入路分別為3例和2例,術中體外循環時間、主動脈阻斷時間、術后TEE測量最大前向血流速度、平均跨瓣壓差和術后ICU住院時間、24h引流量等臨床數據統計見表2。所有患者術中平均轉機時間為61 min,平均主動脈阻斷時間為32.2 mmin,較傳統正中開胸AVR時間明顯縮短,且術后24 h引流量明顯減少,住ICU時間亦有所縮短。所有納入患者術后恢復順利,無瓣周漏、房室傳導阻滯、腦卒中等并發癥發生;見表2。
術后3個月隨訪時生存率100%,所有患者均無心累、氣促、胸痛等癥狀,無房室傳導阻滯、人工瓣膜感染、瓣周漏、腦梗等并發癥發生,紐約心臟協會心功能Ⅰ~Ⅱ級。經胸超聲心動圖示人工瓣膜功能正常,無瓣周漏,血流動力學參數較術后早期無明顯變化,心電圖示竇性心律。
3 討論
AVR是主動脈瓣疾病最有效的治療方法[7]。自1964年首次報道以來,傳統胸部正中切口胸骨全開入路是近半個多世紀AVR手術的經典入路,具有手術視野顯露清楚、操作方便、安全性高、近遠期手術療效可靠等優點。近年來,主動脈瓣病變的治療越來越集中于發展和普及微創手術。隨著MI-AVR和經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)的逐步發展,主動脈瓣病變的外科治療進入微創化時代。
MI-AVR包括MS和MT兩種入路,其中MS是使用最廣泛的方法,MT-AVR往往需要胸腔鏡輔助,操作難度更大,故臨床應用相對更少,但因不損傷骨骼,手術創傷更小、恢復更快。與傳統正中完全開胸AVR相比較,MI-AVR在降低術后并發癥發生率和輸血需求、縮短術后住院時間以及患者滿意度等方面具有更好的臨床結果[8]。盡管既往研究[9-10]顯示MI-AVR與傳統AVR圍術期并發癥發生率和遠期臨床結局差異無統計學意義。但令人意外的是,目前臨床上MI-AVR并未得到廣泛推廣,大部分體外循環下AVR仍然是采用胸骨正中全開的手術方式[1]。這一現象可能與MI-AVR術野較小,顯露困難,增加了術中操作難度,整體手術時間和術中體外循環時間、主動脈阻斷時間均長于傳統胸骨全開AVR有關。免縫合或快速釋放主動脈瓣置換(sutureless and rapid-deployment aortic valve replacement,SURD-AVR)的應用簡化了瓣膜植入方式,省去了術中瓣膜縫合和打結的時間,有助于促進MI-AVR的開展和推廣。
當前臨床中應用的SURD-AVR生物瓣種類包括Perceval S(Corcym,意大利),Edwards Intuity/Intuity Elite(Edwards Lifesciences,美國)和Enable 3F(Medtronic,美國)。其中Edwards Intuity/Intuity Elite和Enable 3F需要在釋放之后將引導線打結,屬于快速釋放生物瓣,只有Perceval S在釋放之后撤除引導線,無需打結,真正實現了免縫合[11]。2018年SURD-AVR國際注冊中心報道了超過3 300例患者SURD-AVR術后的早期臨床結局,結果顯示SURD-AVR是一種可有效替代傳統AVR的手術方法,且有助于促進手術入路微創化,推動MI-AVR的開展和推廣[3]。Szecel等[4]報道了2007—2017年連續納入的468例應用Perceval免縫合生物瓣患者的中期臨床結局,結果顯示人工瓣膜血流動力學良好,無患者因結構性瓣膜退變而再次手術。這一結果充分肯定了Perceval免縫合生物瓣臨床應用的安全性和有效性。另一方面,Fujita等研究發現高達75%的免縫合生物瓣應用于MI-AVR,這一結果充分證實了Perceval免縫合生物瓣在MI-AVR中應用的顯著優勢。Perceval免縫合生物瓣通過簡化的植入方法縮短手術時間彌補了MI-AVR最主要的局限性,Fujita等[12]甚至認為MI-AVR是免縫合生物瓣的首要適應證。
另一方面,TAVR提供了一種全新的人工瓣膜植入方法,且已經取得了較大進展和良好的近中期臨床結果。微創是TAVR的獨特優勢,患者可以避免體外循環,減少輸血量,術后恢復快,住院時間短[13],因此,TAVR已成為高齡高危單純主動脈瓣疾病患者的首選治療方法。隨著TAVR的安全性和可靠性不斷得到證實,其適用范圍不斷擴大,目前對于中低危的高齡患者亦是一種有效的治療選擇[14]。然而,TAVR保留了病變瓣膜,導致其無法適用于如感染性心內膜炎等部分特殊主動脈瓣病變患者。其次,保留嚴重鈣化的瓣葉和瓣環,可能增加TAVR圍術期瓣周漏、腦梗塞和瓣口梗阻等不良事件發生風險和降低人工瓣膜耐久性[15-16]。
瓣周漏是TAVR和免縫合主動脈瓣置換最常見的圍術期不良事件之一,但TAVR發生風險顯著高于免縫合主動脈瓣置換。其主要原因可歸因于MI-AVR術中可切除病變瓣膜,并清除瓣環鈣化,從而降低瓣周漏發生風險。Chung等[17]發現TVAR術后輕中度瓣周漏發生率高達59.7%,而免縫合主動瓣置換瓣周漏發生率僅約8.1%。Okuno等[18]在5年隨訪中發現即使是輕微的瓣周漏也可能是影響長期生存率的風險因素。我們不難發現雖然Chung等[17]的研究結果顯示免縫合主動脈瓣置換術后致命性出血、急性腎損傷、新發心房顫動發生率以及住ICU和總住院時間均高于或長于TVAR,但術后30 d死亡率差異無統計學意義,而術后1年死亡率卻低于TAVR[17]。2022年美國胸外科協會年會報道一項納入2 133例重度主動脈瓣狹窄患者的歐洲多中心研究,經過傾向性評分匹配后研究結果顯示,免縫合組瓣周漏發生率顯著低于TAVR組(0.97% vs. 4.84%,P<0.001),術后9年全因死亡率(36.7% vs.41.8%,P=0.023)和心源性死亡率(10.1% vs. 19.5%,P<0.001)均低于TAVR組。因此,部分學者認為TAVR中遠期死亡率升高的主要原因為TAVR術后瓣周漏發生率明顯高于免縫合AVR。此外,免縫合AVR圍術期永久起搏器植入、腦卒中等并發癥發生率亦低于TAVR[19-21]。免縫合AVR中可直視下切除病變瓣膜,清除鈣化,從而可降低術中鈣化組織脫落導致周圍性栓塞事件發生的風險。同時直視下可準確測量瓣環大小,選擇最佳型號瓣膜,避免人工瓣膜瓣環直徑放大率過大,有助于人工瓣膜釋放過程中精確定位瓣環和保持人工瓣膜與瓣環同軸性,減少對傳導束的影響[22]。
總之,Perceval免縫合生物瓣應用于MI-AVR,最大程度兼顧了微創、圍術期安全性和可靠的遠期療效,為患者提供了一種新的手術治療選擇,具有較好的臨床應用前景。尤其適用于二葉式主動脈瓣畸形、感染性心內膜炎、嚴重瓣膜鈣化和合并其他心臟瓣膜或主動脈病變的高齡患者。在臨床實踐中術前需仔細評估患者主動脈瓣病變和解剖條件,嚴格把握手術指征,并在具備一定微創手術經驗的中心開展此類手術。
利益沖突:無。
作者貢獻:楊鵬負責文章撰寫和修改;劉宇、郎乾鐳和謝毅參與資料收集與術中錄像;李雯帆和王晨昊參與文獻檢索和整理;胡佳對文章的相關內容進行指導和修正。