引用本文: 高在芬, 賀晶, 史建國, 陳葉紅, 羅俊霞, 胡萬冬, 王萌, 周文靜. Aicardi-Goutières 綜合征一例. 癲癇雜志, 2019, 5(2): 88-93. doi: 10.7507/2096-0247.20190015 復制
Aicardi-Goutières 綜合征(Aicardi-Goutière syndrome,AGS)是一組罕見的以神經系統及皮膚受累為主的早發性遺傳性疾病,Aicardi 和 Goutière 于 1984 年首次報道[1]。其典型的臨床表現為早發性腦病,但有時合并嚴重的智力缺損和身體障礙。目前,國內對其認識較少,為提高臨床醫生對該病的診治水平,現將我院 2016 年 8 月 12 日收治的 1 例 AGS 患兒臨床資料報道如下。
1 臨床資料
1.1 一般資料
患兒 女,1 歲 2 月齡,主因“反復發作性肢體抽搐 1 年 2 個月”收入我院。患兒智力運動發育明顯落后于同齡兒,目前不能獨坐、自己翻身、完成爬行及坐、追視物體,不會說話,表情呆滯,呼喚患兒名字無反應。患兒系第二胎第一產,足月順產,出生體重 3.05 kg,無圍產期缺氧史,否認家族遺傳史及類似病史。患兒生后 14 d 無明顯誘因出現驚厥發作,表現為意識喪失、雙手握拳、四肢僵直、雙眼右斜、口唇咂動,無口吐白沫、無大小便失禁,持續數秒后緩解,就診于當地醫院,診斷為“癲癇”。給予丙戊酸鈉(10 mg/kg,每日兩次)口服,患兒仍有發作,每日 4~5 次。患兒于 4 個月開始出現點頭、抱拳樣發作,伴雙眼左斜,每串 20~40 余次,每天數次不等,腦電圖(EEG)示高度失律,考慮嬰兒痙攣癥,當地醫院給予促腎上腺皮質激素(ACTH)(20 U/d,14 d)+硫酸鎂沖擊治療,加用丙戊酸鈉(20 mg/kg,每日兩次)、左乙拉西坦(20 mg/kg,每日兩次)、托吡酯(2 mg/kg,每日兩次)、維生素 B6(75 mg/d),患兒發作次數明顯減少。1 歲 2 月齡時因上呼吸道感染伴發熱,患兒癲癇發作加重,表現為點頭、抱拳,每串 20~40 次,每日 2~8 次,遂就診于清華大學玉泉醫院癲癇中心。
1.2 相關檢查
患兒神志清,發育落后,營養欠佳,體重 12 kg,身長 90 cm,頭圍 44 cm,前囟閉合,眼底示視網膜脈絡膜病變,虹膜無缺損,中心反光未見,色淡,右側視乳頭呈灰白色周圍有散在大小白斑,心肺腹四肢關節未見異常,四肢肌張力低,左側肢體肌力 1 級。
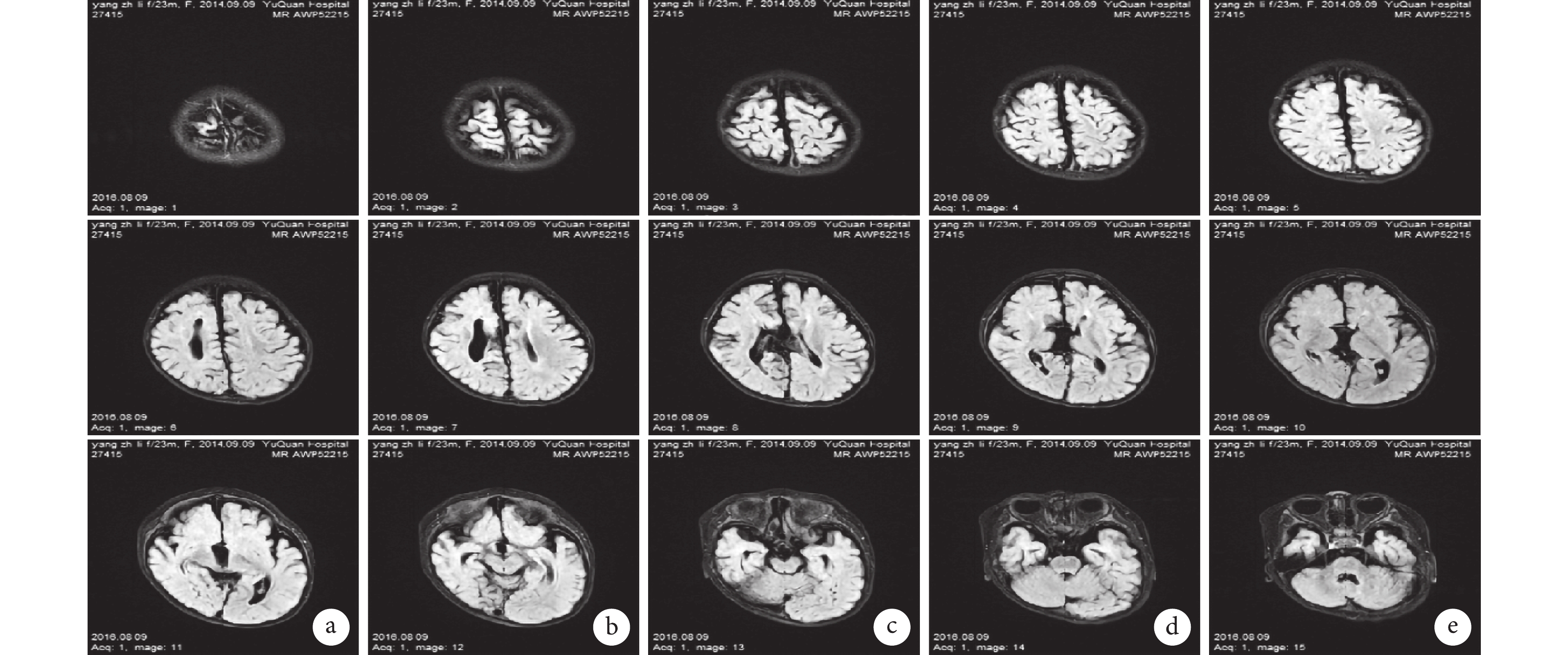
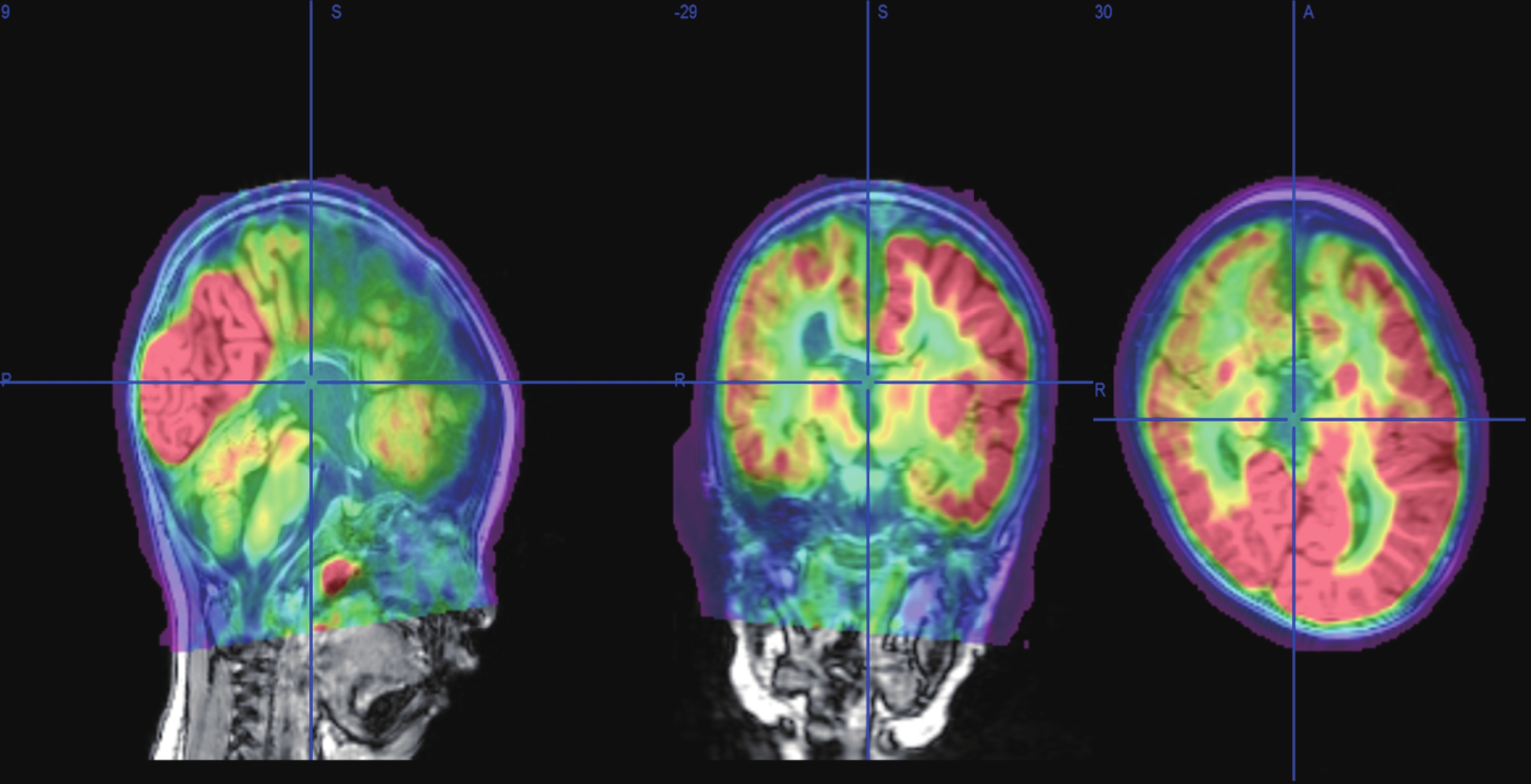
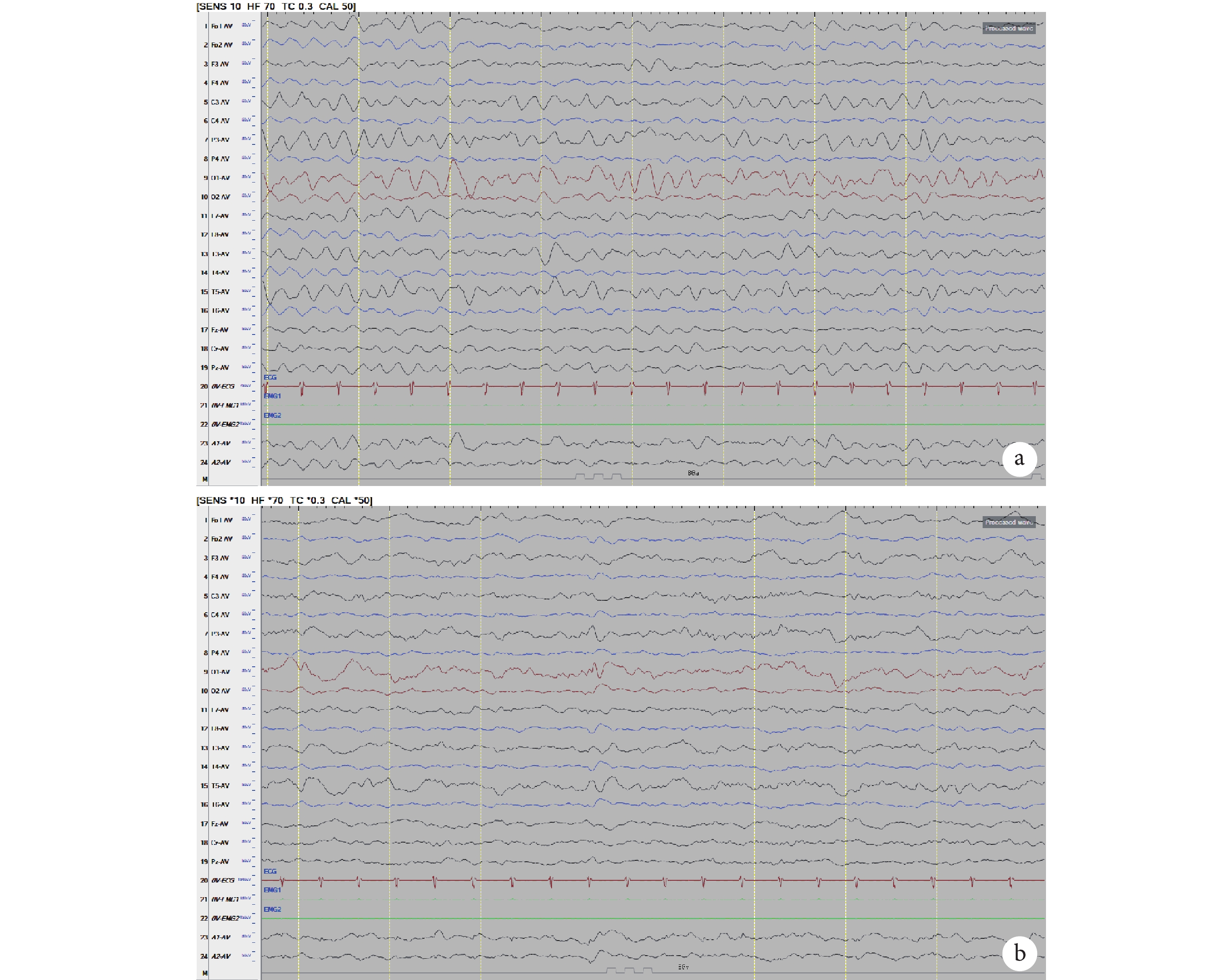
輔助檢查:視頻腦電圖(VEEG)監測示醒睡各期在右半球各導聯可見大量持續性中至高波幅 2~3 Hz 尖-慢波放電,以右側中央-頂、中后顳區為著,左右完全不同步,不對稱,在左側半球各導聯非同步出現較多低至中波幅棘-慢波,多棘-慢波放電、多棘波放電,在監測中記錄到 2 串痙攣發作,四肢快速抖動一下,EEG 表現為:右半球高波幅尖波伴有低波幅快活動→左半球低波幅快活動,持續約 0.5~1.0 s,左右完全分離,并伴有短暫的菱形肌電活動爆發(圖 1)。頭顱核磁共振(MRI)示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位(圖 2)。正電子發射計算機斷層掃描(PET-CT)示右側半球代謝減低(圖 3)。
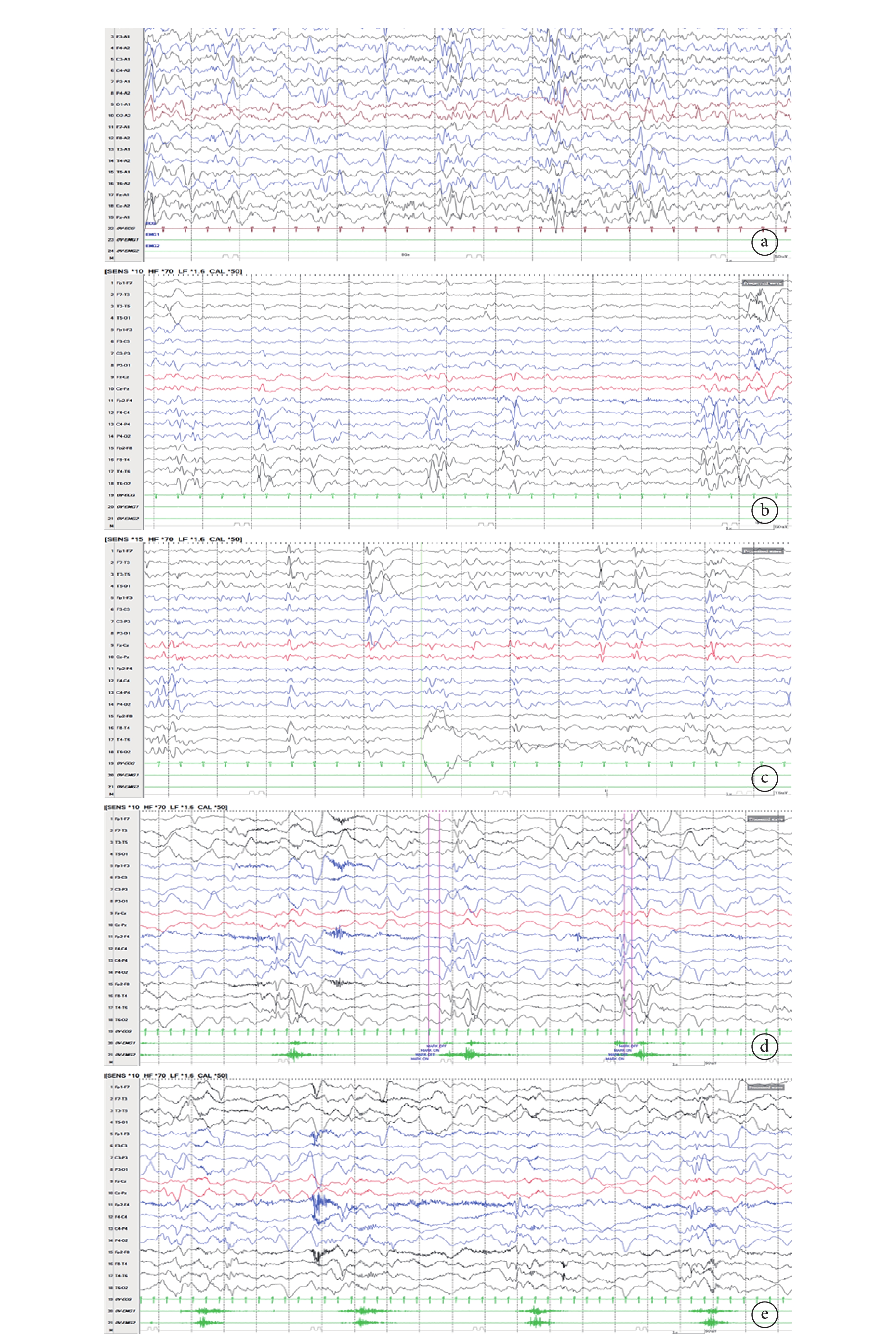 圖1
患兒腦電圖
圖1
患兒腦電圖
a~c,發作間期:醒睡各期在右半球各導聯可見大量持續性中至高波幅 2~3 Hz 尖-慢波放電,以右側中央-頂、中后顳區為著,左右完全不同步,不對稱,在左側半球各導聯非同步出現較多低至中波幅棘-慢波,多棘-慢波放電,多棘波放電。d~e,發作期:右半球高波幅尖波伴有低波幅快活動→左半球低波幅快活動,持續約 0.5~1.0 s,左右完全分離,并伴有短暫的菱形肌電活動爆發
Figure1. EEG of the patienta~c, IID: large continuous high reflection amplitude 2~3 Hz spike-slow wave discharge in the right hemisphere, mainly appear in right central、parital, temporal regions; low to medium amplitude spike-slow wave in the left hemisphere. d~e ID: low amplitude fast wave in right hemisphere→low amplitude fast wave in left hemisphere. It lasts for 0.5~1.0 s with myoelectricity outburst
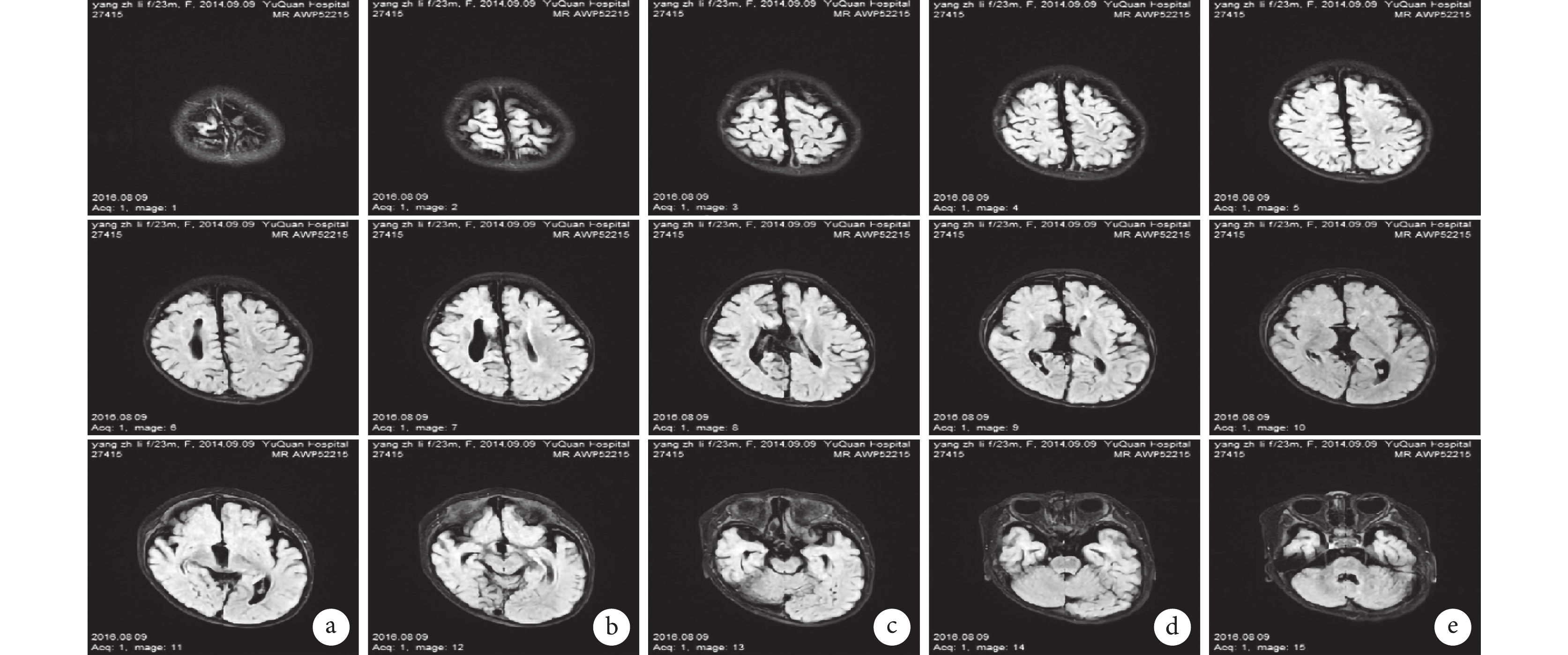 圖2
頭顱核磁共振示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位
Figure2.
MRI shows complete absence of the corpus callosum, polygyria of the right frontal lobe with heterotopic gray matter
圖2
頭顱核磁共振示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位
Figure2.
MRI shows complete absence of the corpus callosum, polygyria of the right frontal lobe with heterotopic gray matter
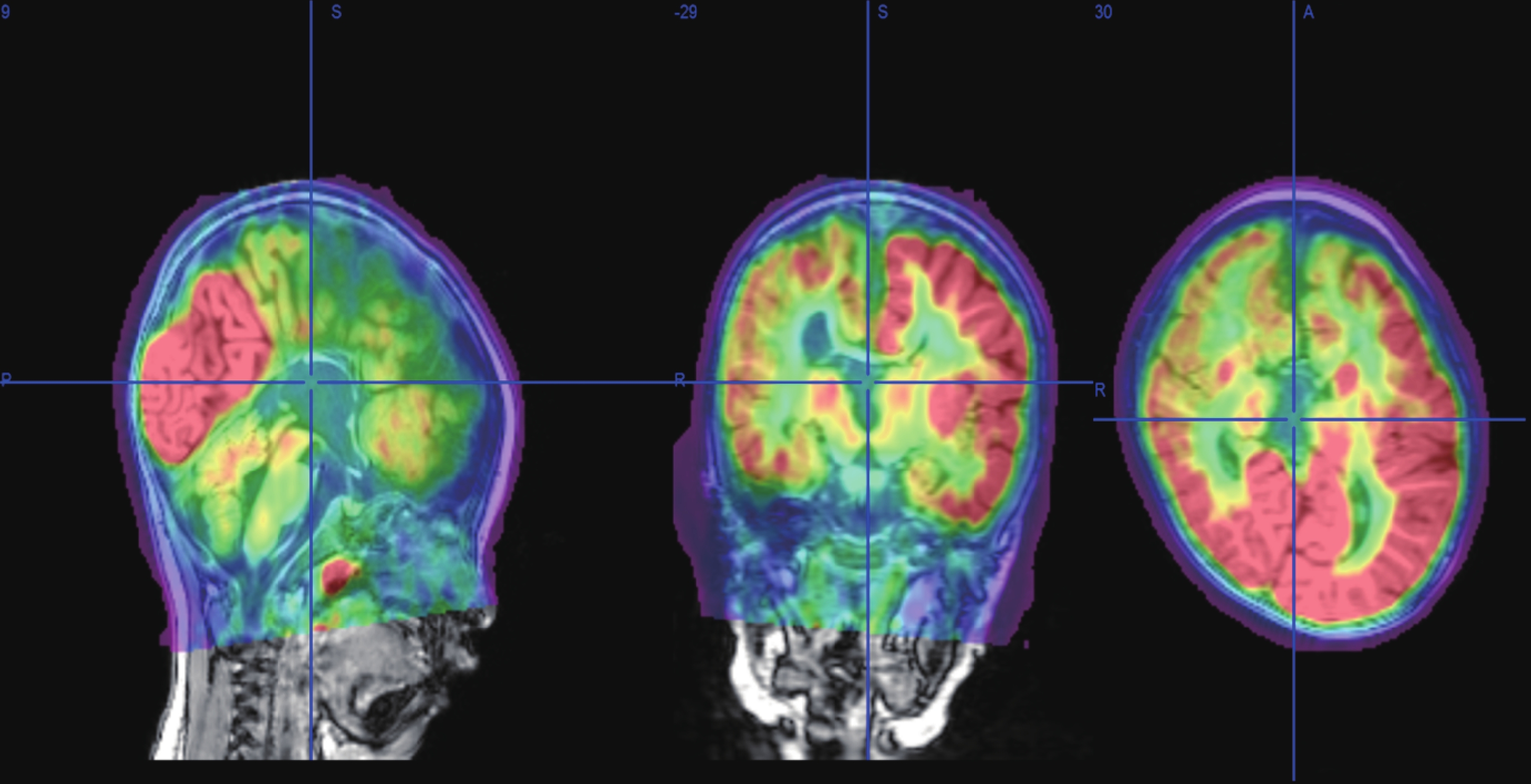 圖3
正電子發射計算機斷層掃描示右側半球代謝減低
Figure3.
PET-CT shows decreased metabolism in the right hemisphere
圖3
正電子發射計算機斷層掃描示右側半球代謝減低
Figure3.
PET-CT shows decreased metabolism in the right hemisphere
1.3 診斷
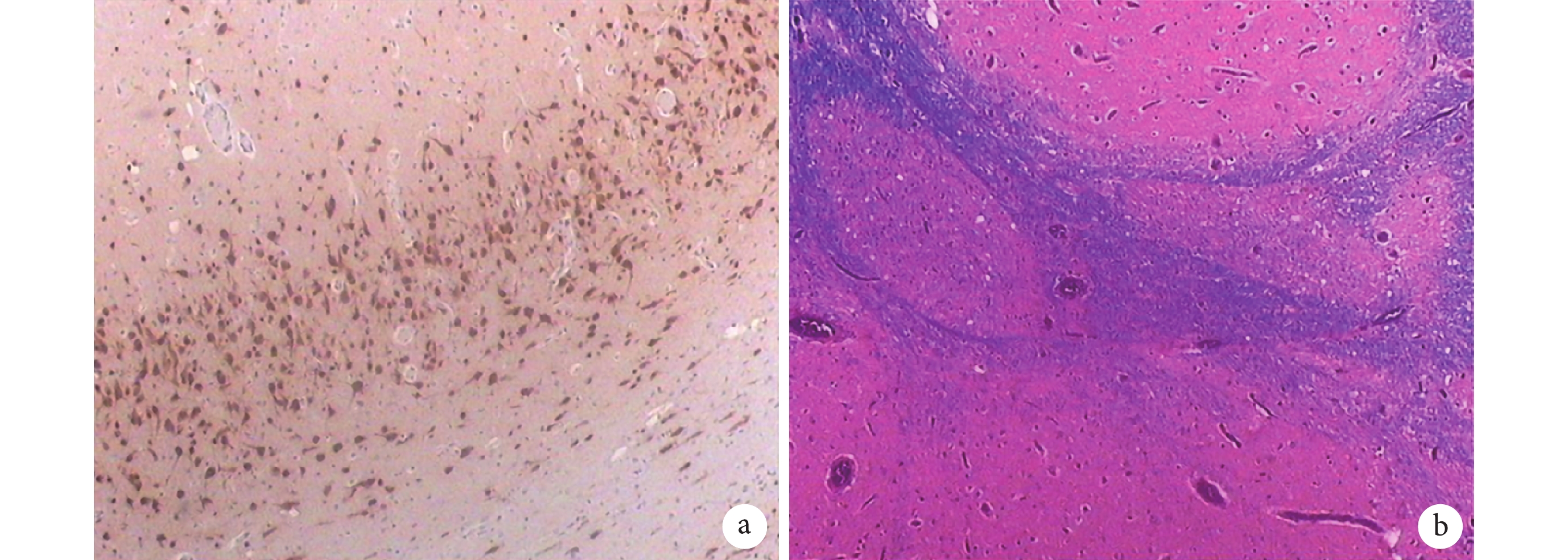
結合患兒癥狀、體征及輔助檢查結果,診斷該患兒為癲癇。綜合多種因素考慮:患兒多種抗癲癇藥物(AEDs)聯合應用效果較差,癲癇發作難以控制,患兒目前查體不能豎頸及坐立,左側肢體偏癱,MRI、PET-CT、EEG 結果均顯示右側半球大面積病灶,左側肢體偏癱和病灶結果相關,經過多次術前評估,外科進行了右側半球切除手術,術前 Wada test 不配合,術后對右側大腦半球做病理結合免疫組織化學和特殊染色結果,考慮大腦皮層嚴重發育不良:側腦室旁灰質異位;多小腦回畸形(圖 4)。術后復查 VEEG 示背景不對稱,右側各導電壓低平,枕區未見優勢節律或活動,右側睡眠波缺如,未見明顯異常放電(圖 5)。術后口服丙戊酸鈉(20 mg/kg,每日兩次)、左乙拉西坦(20 mg/kg,每日兩次)、托吡酯(2 mg/kg,每日兩次)AEDs 聯合治療,隨訪 8 個月未再驚厥發作。隨后患兒再次出現驚厥發作,表現同手術治療前,發作頻率相對較少,及時調整 AEDs 劑量,發作仍可控制。
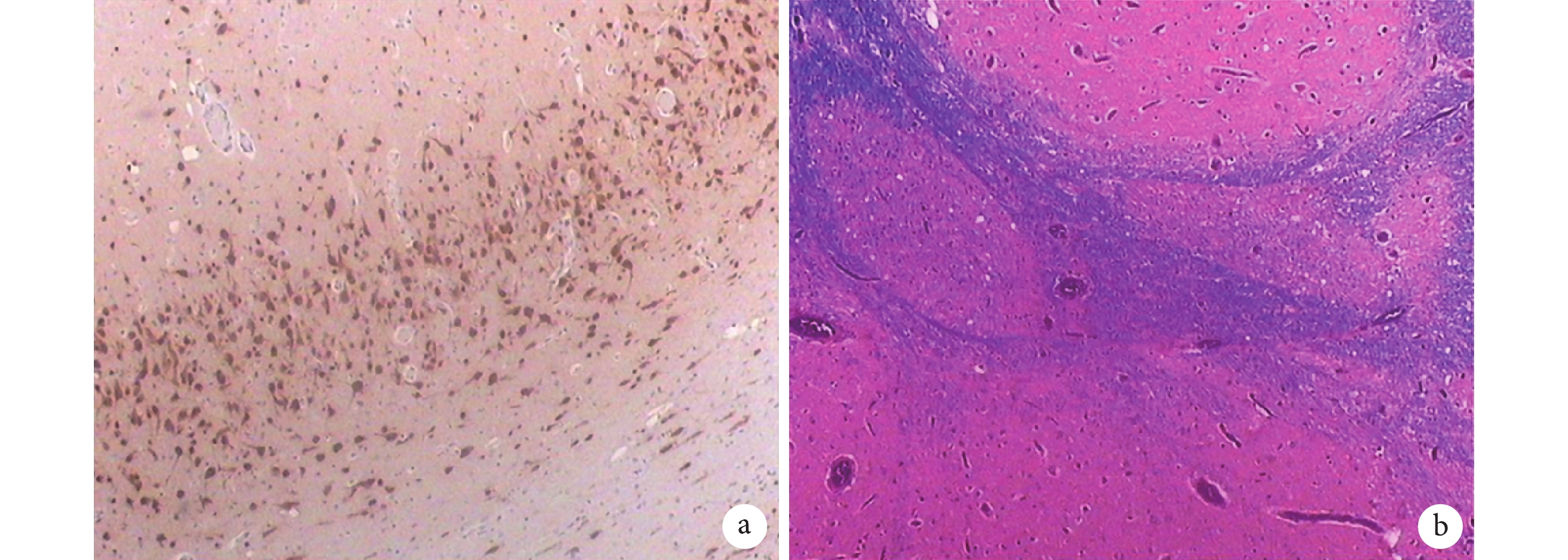 圖4
術后右側大腦半球組織免疫組化及特殊染色結果
圖4
術后右側大腦半球組織免疫組化及特殊染色結果
a. 右側脈絡叢組織鏡檢,部分間質血管擴張充血及出血,局灶蛛網膜上皮增生;b. 右側大腦半球腦組織鏡檢:蛛網膜下腔血管增生和擴張,皮層神經元排列構筑嚴重紊亂,部分皮層明顯變薄、層次缺失、神經元減少、緊湊排列、呈多小腦回畸形樣結構,部分側腦室旁白質內見間斷不均分布的多灶狀大小不一的灰質小團塊,其余皮層神經元見多灶性層狀缺失和小灶狀微柱狀排列,見散在的肥大神經元和呈慢性缺血性改變的神經元,部分灰白質界限不清,部分白質內異位神經元增多
Figure4. Results of immunohistochemistry and special staining in right cerebral hemisphere after operationa. Microscopic examination of the right choroid plexus showed dilatation, hyperemia and hemorrhage of some interstitial blood vessels, and focal arachnoid epithelial hyperplasia; b. Right cerebral hemisphere tissue microscopy: subarachnoid blood vessel growth and expansion, cortex neurons to arrange build serious disorder, part of the cortex significantly reduce thinning, lack of hierarchy and neurons in the multiple cerebellum, compaction, back to the deformed sample structure, part of the lateral ventricle narrator see uneven distribution of multifocal within the mass are of different sizes small gray matter clumps, see the rest of the cortex neuron multifocal layer is missing and micro column arrangement, see scattered mast chronic ischemic change of neurons, neurons and the grey part mass line is not clear, part of the increase in ectopic neurons in white matter
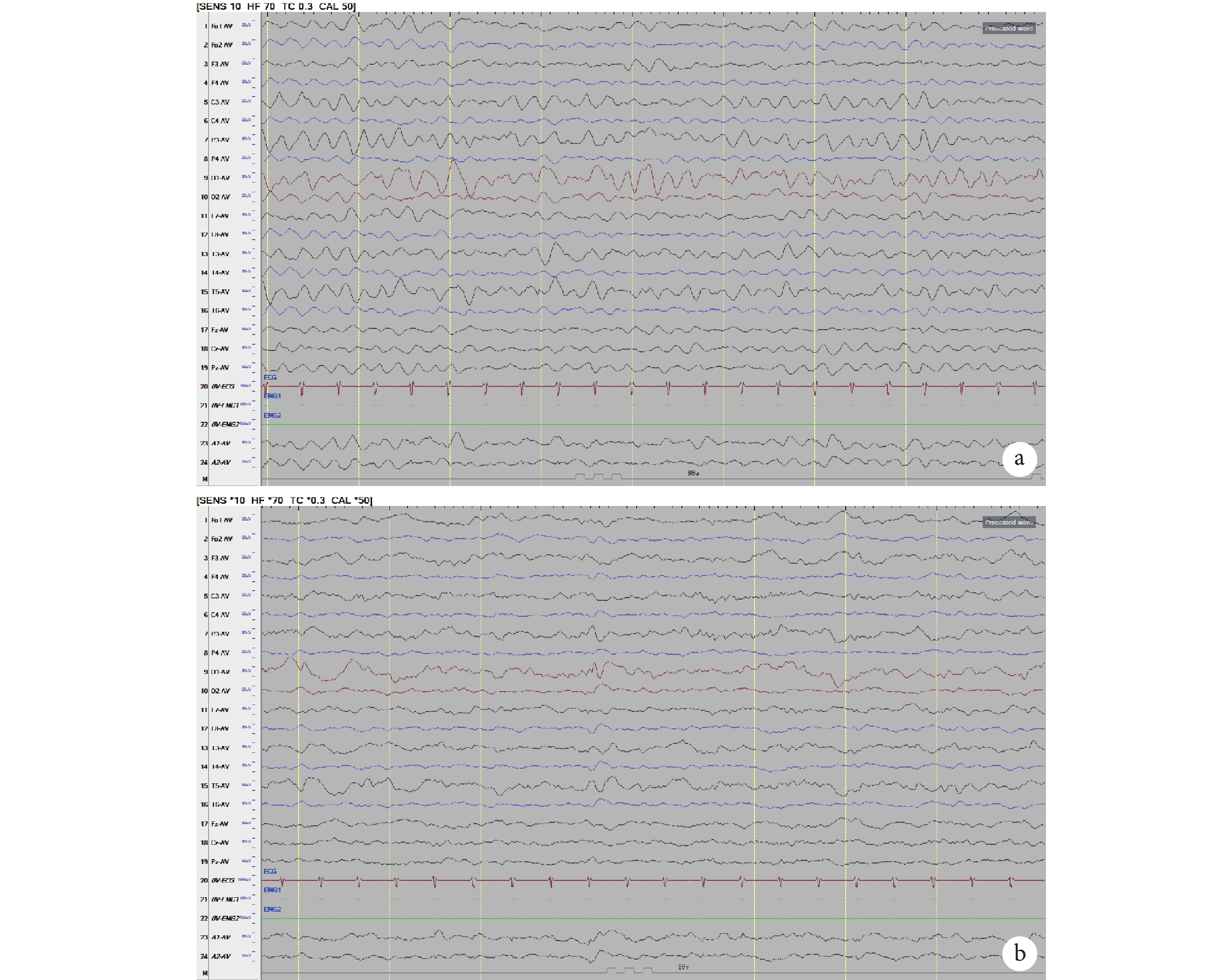 圖5
術后復查視頻腦電圖
圖5
術后復查視頻腦電圖
a、b 示左側半球可見 4~6 Hz θ 活動,右側半球以低電壓為主,左側紡錘波如期出現
Figure5. Post-operative review of VEEGa, b 4~6 Hz θ was observed in the left hemisphere, low voltage in the right hemisphere, the left spindle appeared as scheduled
2 討論
AGS 通常最典型表現為早發性腦病,但有時是會合并嚴重的智力缺損和身體障礙,是一種罕見的以腦白質受累為主的遺傳性腦病[2]。有部分嬰兒的 AGS 為出生時發現神經系統異常、肝脾腫大、肝酶素升高、血小板減少,從影像來看高度懷疑是先天性感染[3]。除此之外,大部分患病的嬰兒在出生后會有一段看似正常的發展,在之后數周不等的時間內,開始有癥狀出現。
致病基因及發病機制,AGS 相關基因包括 RNASEH2A、RNASEH2B、RNASEH2C、SAMHD1 基因,屬常染色體隱性遺傳[4]。少數 TREX1 及 ADAR 基因引起[5, 6]。外界病原或自身胞漿 DNA 作用于Ⅰ型干擾素(IFN)基因刺激因子(Stimulator of interferon gene,STING)和 DNA 依賴的 IFN 調節因子激活因子(DNA dependent activator of IFN regulatory factor,DAI),亦可刺激產生Ⅰ型 IFN。Ⅰ型 IFN 產生 Toll 樣受體(Toll-1ikereceptor,TLR)依賴和非 TLR 依賴途徑。TLR 依賴途徑識別 dsRNA、富含鳥嘌呤核苷和尿嘧啶的 ss?RNA 或非甲基化胞嘧啶-磷酸-鳥嘌呤基序,活化下游信號通路,導致產生Ⅰ型 IFN[7]。非 TLR 依賴途徑的胞漿核酸傳感器包括維甲酸誘導基因 1(RIG1)和黑色素瘤分化相關基因 5(MDA5)。由于基因缺陷,導致核酸酶活性降低或喪失,胞漿內核酸堆積,被 STING、RIG1、MDA5 或 DAI 識別感應,促使 STING-TBK1-IRFs 等信號通路過度活化,最終導致Ⅰ型 IFN 水平顯著增加[8]。另外 IFIH1 基因功能突變,使 MDA5 對 RNA 的識別能力增強,進一步使Ⅰ型 IFN 產生增多。Ⅰ型 IFN 通過作用于 IFN 異二聚體受體,促使 TYK2 和 JAK1 磷酸化,最終使 IFN 刺激相關基因轉錄增加。同時Ⅰ型 IFN 也可以揮自我強化作用,另外Ⅰ型 IFN 還可促進自身反應性 T 細胞活化、B 細胞分化為漿細胞并產生自身抗體,使機體產生自身免疫性損傷[7]。
其典型的臨床表現:① 包括嚴重的智力運動發育落后或倒退,錐體束及錐體外系癥狀和體征;② 癲癇痙攣發作為主,也可以有其他類型的發作,患兒起病年齡都很早,多數患兒在生后 3 個月內起病,23% 起病年齡在生后 1 個月內,68% 在出生后 3 個月內起病[9]。發作間期 EEG 表現為高度失律占 18%,最常見的異常是左右半球完全不同步、不對稱的類周期性,即暴發抑制 EEG 放電占 76%,這種暴發左右完全分離,兩側可見不同的波形、振幅、時限,由此可見在兩側半球有各自的腦電活動,稱之為分離 EEG[10];③ 精神運動發育落后;④ 眼部畸形為嚴重的脈絡膜病,并伴有視神經缺損,視乳頭發育不良和小眼球,眼電圖和 VEP 檢查大部分是正常的;⑤ 頭顱影像學改變:主要為胼胝體發育不良,透明隔穹窿缺如,腦室擴大,輪廓多不規則,腦穿通畸形脈絡叢異常,巨腦回等;⑥ 與該病相關的 ADAR、SAMHD1、IFIH1、TREX1、RNASEH2A 等基因突變均被報道過。鑒于均為女性發病,可能是 X 染色體顯性基因突變的結果[11]。
診斷以囊性腦白質營養不良(額顳骨的較為顯著)、鈣化(包括基底神經節以及腦白質)以及皮質-皮質下萎縮是診斷時的基本依據,且經常與腦干、胼胝體以及小腦的萎縮相聯系。基因測序顯示 RNASEH2B、RNASEH2C、RNASEH2A、TREX1、SAMHD1、ADAR 或 IFIH1 基因突變,極少數可能由未知基因突變所致。
本例患兒為新生兒期起病,難以控制的痙攣發作,左右半球的分離 EEG,胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位,眼底檢查右側視乳頭呈灰白色周圍有散在大小白斑,術后腦組織病理切片顯示多小腦回畸形及白質神經元病變,根據臨床表現及病理表現此病診斷為 Aicardi-Goutières 綜合征,患兒家屬由于家庭原因未做基因檢測。
AGS 目前沒有確切的治療方法,臨床一般對癥治療(防止嗆咳及誤吸、鼻飼喂養、AEDs 等)或經驗運用丙種球蛋白(IVIG)和(或)糖皮質激素。生物制劑是目前也開始運用到了其臨床治療,理論上,抗 IFN-α 單克隆抗體是 AGS 的有效治療藥物[12],但目前尚未有相關臨床研究報道。有研究表明托珠單抗可有效緩解腦血管病變,減少激素劑量,改善實驗室指標[13],但托珠單抗在 AGS 患兒中的療效及安全性有待進一步研究評估。
AGS 預后不良,各種藥物效果較差,癲癇發作難以控制,本例患兒由于癲癇時常發作,對其進行對癥治療,經過嚴格術前評估,對該患兒于清華玉泉醫院癲癇中心行右側半球切除手術。術后復查 VEEG,發作間期異常放電消失。術后 AEDs 聯合治療,隨訪 8 個月未再驚厥發作。但 8 個月后患兒再次出現驚厥發作,及時調整 AEDs 劑量,發作控制。現隨訪時間 2 年,患兒未再驚厥發作,智能改善,左側肢體經康復鍛煉后肌力 2+級。手術治療改善了 AGS 患兒難治性的驚厥發作,其遠期預后我們將進一步隨訪及深入研究。
Aicardi-Goutières 綜合征(Aicardi-Goutière syndrome,AGS)是一組罕見的以神經系統及皮膚受累為主的早發性遺傳性疾病,Aicardi 和 Goutière 于 1984 年首次報道[1]。其典型的臨床表現為早發性腦病,但有時合并嚴重的智力缺損和身體障礙。目前,國內對其認識較少,為提高臨床醫生對該病的診治水平,現將我院 2016 年 8 月 12 日收治的 1 例 AGS 患兒臨床資料報道如下。
1 臨床資料
1.1 一般資料
患兒 女,1 歲 2 月齡,主因“反復發作性肢體抽搐 1 年 2 個月”收入我院。患兒智力運動發育明顯落后于同齡兒,目前不能獨坐、自己翻身、完成爬行及坐、追視物體,不會說話,表情呆滯,呼喚患兒名字無反應。患兒系第二胎第一產,足月順產,出生體重 3.05 kg,無圍產期缺氧史,否認家族遺傳史及類似病史。患兒生后 14 d 無明顯誘因出現驚厥發作,表現為意識喪失、雙手握拳、四肢僵直、雙眼右斜、口唇咂動,無口吐白沫、無大小便失禁,持續數秒后緩解,就診于當地醫院,診斷為“癲癇”。給予丙戊酸鈉(10 mg/kg,每日兩次)口服,患兒仍有發作,每日 4~5 次。患兒于 4 個月開始出現點頭、抱拳樣發作,伴雙眼左斜,每串 20~40 余次,每天數次不等,腦電圖(EEG)示高度失律,考慮嬰兒痙攣癥,當地醫院給予促腎上腺皮質激素(ACTH)(20 U/d,14 d)+硫酸鎂沖擊治療,加用丙戊酸鈉(20 mg/kg,每日兩次)、左乙拉西坦(20 mg/kg,每日兩次)、托吡酯(2 mg/kg,每日兩次)、維生素 B6(75 mg/d),患兒發作次數明顯減少。1 歲 2 月齡時因上呼吸道感染伴發熱,患兒癲癇發作加重,表現為點頭、抱拳,每串 20~40 次,每日 2~8 次,遂就診于清華大學玉泉醫院癲癇中心。
1.2 相關檢查
患兒神志清,發育落后,營養欠佳,體重 12 kg,身長 90 cm,頭圍 44 cm,前囟閉合,眼底示視網膜脈絡膜病變,虹膜無缺損,中心反光未見,色淡,右側視乳頭呈灰白色周圍有散在大小白斑,心肺腹四肢關節未見異常,四肢肌張力低,左側肢體肌力 1 級。
輔助檢查:視頻腦電圖(VEEG)監測示醒睡各期在右半球各導聯可見大量持續性中至高波幅 2~3 Hz 尖-慢波放電,以右側中央-頂、中后顳區為著,左右完全不同步,不對稱,在左側半球各導聯非同步出現較多低至中波幅棘-慢波,多棘-慢波放電、多棘波放電,在監測中記錄到 2 串痙攣發作,四肢快速抖動一下,EEG 表現為:右半球高波幅尖波伴有低波幅快活動→左半球低波幅快活動,持續約 0.5~1.0 s,左右完全分離,并伴有短暫的菱形肌電活動爆發(圖 1)。頭顱核磁共振(MRI)示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位(圖 2)。正電子發射計算機斷層掃描(PET-CT)示右側半球代謝減低(圖 3)。
 圖1
患兒腦電圖
圖1
患兒腦電圖
a~c,發作間期:醒睡各期在右半球各導聯可見大量持續性中至高波幅 2~3 Hz 尖-慢波放電,以右側中央-頂、中后顳區為著,左右完全不同步,不對稱,在左側半球各導聯非同步出現較多低至中波幅棘-慢波,多棘-慢波放電,多棘波放電。d~e,發作期:右半球高波幅尖波伴有低波幅快活動→左半球低波幅快活動,持續約 0.5~1.0 s,左右完全分離,并伴有短暫的菱形肌電活動爆發
Figure1. EEG of the patienta~c, IID: large continuous high reflection amplitude 2~3 Hz spike-slow wave discharge in the right hemisphere, mainly appear in right central、parital, temporal regions; low to medium amplitude spike-slow wave in the left hemisphere. d~e ID: low amplitude fast wave in right hemisphere→low amplitude fast wave in left hemisphere. It lasts for 0.5~1.0 s with myoelectricity outburst
 圖2
頭顱核磁共振示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位
Figure2.
MRI shows complete absence of the corpus callosum, polygyria of the right frontal lobe with heterotopic gray matter
圖2
頭顱核磁共振示胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位
Figure2.
MRI shows complete absence of the corpus callosum, polygyria of the right frontal lobe with heterotopic gray matter
 圖3
正電子發射計算機斷層掃描示右側半球代謝減低
Figure3.
PET-CT shows decreased metabolism in the right hemisphere
圖3
正電子發射計算機斷層掃描示右側半球代謝減低
Figure3.
PET-CT shows decreased metabolism in the right hemisphere
1.3 診斷
結合患兒癥狀、體征及輔助檢查結果,診斷該患兒為癲癇。綜合多種因素考慮:患兒多種抗癲癇藥物(AEDs)聯合應用效果較差,癲癇發作難以控制,患兒目前查體不能豎頸及坐立,左側肢體偏癱,MRI、PET-CT、EEG 結果均顯示右側半球大面積病灶,左側肢體偏癱和病灶結果相關,經過多次術前評估,外科進行了右側半球切除手術,術前 Wada test 不配合,術后對右側大腦半球做病理結合免疫組織化學和特殊染色結果,考慮大腦皮層嚴重發育不良:側腦室旁灰質異位;多小腦回畸形(圖 4)。術后復查 VEEG 示背景不對稱,右側各導電壓低平,枕區未見優勢節律或活動,右側睡眠波缺如,未見明顯異常放電(圖 5)。術后口服丙戊酸鈉(20 mg/kg,每日兩次)、左乙拉西坦(20 mg/kg,每日兩次)、托吡酯(2 mg/kg,每日兩次)AEDs 聯合治療,隨訪 8 個月未再驚厥發作。隨后患兒再次出現驚厥發作,表現同手術治療前,發作頻率相對較少,及時調整 AEDs 劑量,發作仍可控制。
 圖4
術后右側大腦半球組織免疫組化及特殊染色結果
圖4
術后右側大腦半球組織免疫組化及特殊染色結果
a. 右側脈絡叢組織鏡檢,部分間質血管擴張充血及出血,局灶蛛網膜上皮增生;b. 右側大腦半球腦組織鏡檢:蛛網膜下腔血管增生和擴張,皮層神經元排列構筑嚴重紊亂,部分皮層明顯變薄、層次缺失、神經元減少、緊湊排列、呈多小腦回畸形樣結構,部分側腦室旁白質內見間斷不均分布的多灶狀大小不一的灰質小團塊,其余皮層神經元見多灶性層狀缺失和小灶狀微柱狀排列,見散在的肥大神經元和呈慢性缺血性改變的神經元,部分灰白質界限不清,部分白質內異位神經元增多
Figure4. Results of immunohistochemistry and special staining in right cerebral hemisphere after operationa. Microscopic examination of the right choroid plexus showed dilatation, hyperemia and hemorrhage of some interstitial blood vessels, and focal arachnoid epithelial hyperplasia; b. Right cerebral hemisphere tissue microscopy: subarachnoid blood vessel growth and expansion, cortex neurons to arrange build serious disorder, part of the cortex significantly reduce thinning, lack of hierarchy and neurons in the multiple cerebellum, compaction, back to the deformed sample structure, part of the lateral ventricle narrator see uneven distribution of multifocal within the mass are of different sizes small gray matter clumps, see the rest of the cortex neuron multifocal layer is missing and micro column arrangement, see scattered mast chronic ischemic change of neurons, neurons and the grey part mass line is not clear, part of the increase in ectopic neurons in white matter
 圖5
術后復查視頻腦電圖
圖5
術后復查視頻腦電圖
a、b 示左側半球可見 4~6 Hz θ 活動,右側半球以低電壓為主,左側紡錘波如期出現
Figure5. Post-operative review of VEEGa, b 4~6 Hz θ was observed in the left hemisphere, low voltage in the right hemisphere, the left spindle appeared as scheduled
2 討論
AGS 通常最典型表現為早發性腦病,但有時是會合并嚴重的智力缺損和身體障礙,是一種罕見的以腦白質受累為主的遺傳性腦病[2]。有部分嬰兒的 AGS 為出生時發現神經系統異常、肝脾腫大、肝酶素升高、血小板減少,從影像來看高度懷疑是先天性感染[3]。除此之外,大部分患病的嬰兒在出生后會有一段看似正常的發展,在之后數周不等的時間內,開始有癥狀出現。
致病基因及發病機制,AGS 相關基因包括 RNASEH2A、RNASEH2B、RNASEH2C、SAMHD1 基因,屬常染色體隱性遺傳[4]。少數 TREX1 及 ADAR 基因引起[5, 6]。外界病原或自身胞漿 DNA 作用于Ⅰ型干擾素(IFN)基因刺激因子(Stimulator of interferon gene,STING)和 DNA 依賴的 IFN 調節因子激活因子(DNA dependent activator of IFN regulatory factor,DAI),亦可刺激產生Ⅰ型 IFN。Ⅰ型 IFN 產生 Toll 樣受體(Toll-1ikereceptor,TLR)依賴和非 TLR 依賴途徑。TLR 依賴途徑識別 dsRNA、富含鳥嘌呤核苷和尿嘧啶的 ss?RNA 或非甲基化胞嘧啶-磷酸-鳥嘌呤基序,活化下游信號通路,導致產生Ⅰ型 IFN[7]。非 TLR 依賴途徑的胞漿核酸傳感器包括維甲酸誘導基因 1(RIG1)和黑色素瘤分化相關基因 5(MDA5)。由于基因缺陷,導致核酸酶活性降低或喪失,胞漿內核酸堆積,被 STING、RIG1、MDA5 或 DAI 識別感應,促使 STING-TBK1-IRFs 等信號通路過度活化,最終導致Ⅰ型 IFN 水平顯著增加[8]。另外 IFIH1 基因功能突變,使 MDA5 對 RNA 的識別能力增強,進一步使Ⅰ型 IFN 產生增多。Ⅰ型 IFN 通過作用于 IFN 異二聚體受體,促使 TYK2 和 JAK1 磷酸化,最終使 IFN 刺激相關基因轉錄增加。同時Ⅰ型 IFN 也可以揮自我強化作用,另外Ⅰ型 IFN 還可促進自身反應性 T 細胞活化、B 細胞分化為漿細胞并產生自身抗體,使機體產生自身免疫性損傷[7]。
其典型的臨床表現:① 包括嚴重的智力運動發育落后或倒退,錐體束及錐體外系癥狀和體征;② 癲癇痙攣發作為主,也可以有其他類型的發作,患兒起病年齡都很早,多數患兒在生后 3 個月內起病,23% 起病年齡在生后 1 個月內,68% 在出生后 3 個月內起病[9]。發作間期 EEG 表現為高度失律占 18%,最常見的異常是左右半球完全不同步、不對稱的類周期性,即暴發抑制 EEG 放電占 76%,這種暴發左右完全分離,兩側可見不同的波形、振幅、時限,由此可見在兩側半球有各自的腦電活動,稱之為分離 EEG[10];③ 精神運動發育落后;④ 眼部畸形為嚴重的脈絡膜病,并伴有視神經缺損,視乳頭發育不良和小眼球,眼電圖和 VEP 檢查大部分是正常的;⑤ 頭顱影像學改變:主要為胼胝體發育不良,透明隔穹窿缺如,腦室擴大,輪廓多不規則,腦穿通畸形脈絡叢異常,巨腦回等;⑥ 與該病相關的 ADAR、SAMHD1、IFIH1、TREX1、RNASEH2A 等基因突變均被報道過。鑒于均為女性發病,可能是 X 染色體顯性基因突變的結果[11]。
診斷以囊性腦白質營養不良(額顳骨的較為顯著)、鈣化(包括基底神經節以及腦白質)以及皮質-皮質下萎縮是診斷時的基本依據,且經常與腦干、胼胝體以及小腦的萎縮相聯系。基因測序顯示 RNASEH2B、RNASEH2C、RNASEH2A、TREX1、SAMHD1、ADAR 或 IFIH1 基因突變,極少數可能由未知基因突變所致。
本例患兒為新生兒期起病,難以控制的痙攣發作,左右半球的分離 EEG,胼胝體完全缺如,右側額葉多小腦回畸形伴灰質異位,眼底檢查右側視乳頭呈灰白色周圍有散在大小白斑,術后腦組織病理切片顯示多小腦回畸形及白質神經元病變,根據臨床表現及病理表現此病診斷為 Aicardi-Goutières 綜合征,患兒家屬由于家庭原因未做基因檢測。
AGS 目前沒有確切的治療方法,臨床一般對癥治療(防止嗆咳及誤吸、鼻飼喂養、AEDs 等)或經驗運用丙種球蛋白(IVIG)和(或)糖皮質激素。生物制劑是目前也開始運用到了其臨床治療,理論上,抗 IFN-α 單克隆抗體是 AGS 的有效治療藥物[12],但目前尚未有相關臨床研究報道。有研究表明托珠單抗可有效緩解腦血管病變,減少激素劑量,改善實驗室指標[13],但托珠單抗在 AGS 患兒中的療效及安全性有待進一步研究評估。
AGS 預后不良,各種藥物效果較差,癲癇發作難以控制,本例患兒由于癲癇時常發作,對其進行對癥治療,經過嚴格術前評估,對該患兒于清華玉泉醫院癲癇中心行右側半球切除手術。術后復查 VEEG,發作間期異常放電消失。術后 AEDs 聯合治療,隨訪 8 個月未再驚厥發作。但 8 個月后患兒再次出現驚厥發作,及時調整 AEDs 劑量,發作控制。現隨訪時間 2 年,患兒未再驚厥發作,智能改善,左側肢體經康復鍛煉后肌力 2+級。手術治療改善了 AGS 患兒難治性的驚厥發作,其遠期預后我們將進一步隨訪及深入研究。