依托循證研究和教學經驗,進行文獻和書籍調研,總結指標計算和轉換、臨床研究注冊、循證醫學研究常用數據庫及文獻質量評價工具和報告規范四個主體需求,采用前后端技術開發循證醫學研究助手在線平臺,可使用www.ebm-helper.cn進行訪問。該平臺目前已納入46個場景的指標計算和轉換、7個臨床研究注冊平臺簡介、26個常用循證醫學研究數據庫導航、29個常用文獻質量評價工具和報告規范索引。循證醫學研究助手在線平臺可幫助研究者解決在開展循證醫學研究的不同階段遇到的具體問題,推廣該平臺在循證醫學教育和研究中的應用,可幫助研究者合理使用工具,提高研究效率。
引用本文: 黃橋, 王宇, 馬文昊, 王永博, 李緒輝, 曾憲濤, 靳英輝. 循證醫學研究助手在線平臺的開發和簡介. 中國循證醫學雜志, 2022, 22(12): 1483-1488. doi: 10.7507/1672-2531.202208041 復制
循證醫學是遵循證據的醫學,要求臨床醫生在對患者做出診治決策時盡可能慎重、準確和明智地應用最佳、最新的科學證據[1]。近幾年,循證醫學一直是醫學領城的研究熱點,但在開展循證醫學研究的不同階段,研究者往往會面臨各種問題。這一系列問題耗費研究者大量時間去查找資料,可能會影響循證醫學研究的順利展開。例如,在開展系統評價/Meta分析時,推薦提前將研究問題和研究方案在共享平臺進行公開和備案;確定臨床問題后,需要選擇合適數據庫進行有效且充分檢索;若進行Meta分析,在提取數據階段,納入文獻可能采用不同效應指標報告效應量,導致格式可能會不一致,需要進行恰當轉換才能導入軟件進行Meta合并;納入的文獻質量參差不齊,需要選擇恰當的工具進行質量評價;最后,在原始研究、系統評價和臨床實踐指南的寫作,推薦參考相應的報告規范進行完整描述,保證臨床研究結論的可靠性。
目前,國外研究者開發了系統評價加速器平臺(https://sr-accelerator.com/),為系統評價中的部分過程提供輔助工具,如文獻檢索式轉換(polyglot search)、文獻篩選(screenatron)和對比文獻篩選結果(disputatron),加速系統評價制作過程[2]。此外,Hannah將系統評價中使用的各類工具匯總,建立檢索平臺提供工具的跳轉(http://systematicreviewtools.com/)。但這兩個平臺均為英文,未收集效應指標的計算和轉換,且未整合中英文工具。依托循證與轉化中心的單位資源,結合多年循證研究和教學經驗,筆者采用前端(Html/CSS/JavaScript)、后端(PHP)和統計軟件(R)結合開發了本土的循證醫學研究助手,并在線發布在www.ebm-helper.cn。目前,該平臺包括四個模塊:指標計算和轉換模塊、循證醫學研究注冊平臺、循證醫學常用數據庫導航及常用文獻質量評價工具和報告規范。為幫助循證醫學研究者了解和使用平臺內容,本文對四個模塊進行詳細介紹。
1 指標計算和轉換模塊
納入原始研究在報告結果時采用的效應指標或數據格式可能會不一致,或未采用Meta分析常用軟件所需的格式,例如有些研究報告的是均數差和標準差,而有些研究采用均數差和對應的95%可信區間,需要將可信區間轉換成標準差,再輸入Meta分析軟件中。在預后研究中,部分文獻提供生存曲線,但未提供效應量風險比(hazard ratio,HR)及其可信區間。為盡可能保留更多有效的文獻數,可嘗試進行指標轉換,統一數據格式后再進行Meta分析。
經過前期文獻和書籍調研,在“指標計算和轉換”模塊中納入了46個場景的計算。選擇導航欄中“指標計算和轉換”菜單,按照變量類和目的分設有4個子菜單。研究者在使用時應注意每個場景要求的結局指標類型、效應指標類型和注意事項說明,此外,可參考每個場景計算提供的參考文獻,了解計算和轉換的原理。
1.1 效應指標轉換地圖
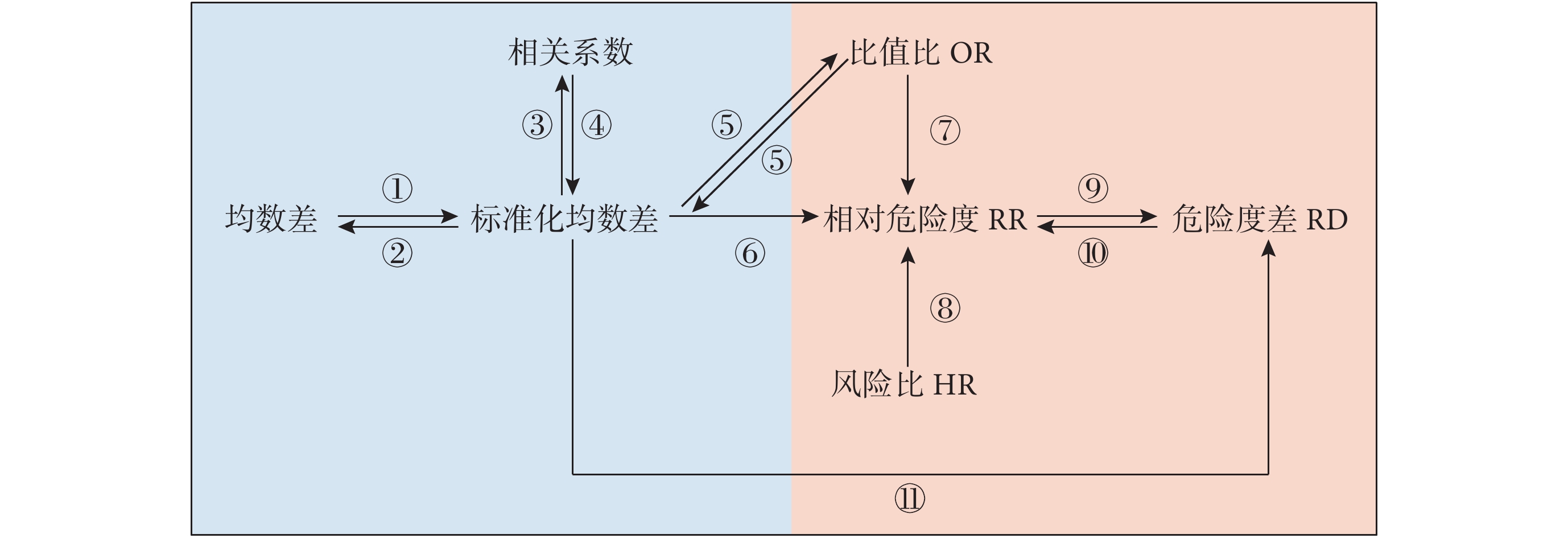
見圖1。連續變量結局的效應指標包括均數差、標準化均數差和相關系數(藍色區域)。分類(生存)變量結局的效應指標包括比值比(odds ratio,OR)、相對危險度(relative risk,RR)、危險度差和HR。該頁面將不同的效應指標之間可能的轉換關系進行整合,每個箭頭上的數字配有相應的鏈接,可跳轉至相應頁面完成計算和轉換。特別注意,不同類型結局的效應指標之間的轉換,需嚴格遵守前提假設進行。
 圖1
效應指標轉換關系
圖1
效應指標轉換關系
1.2 連續變量結局的效應指標
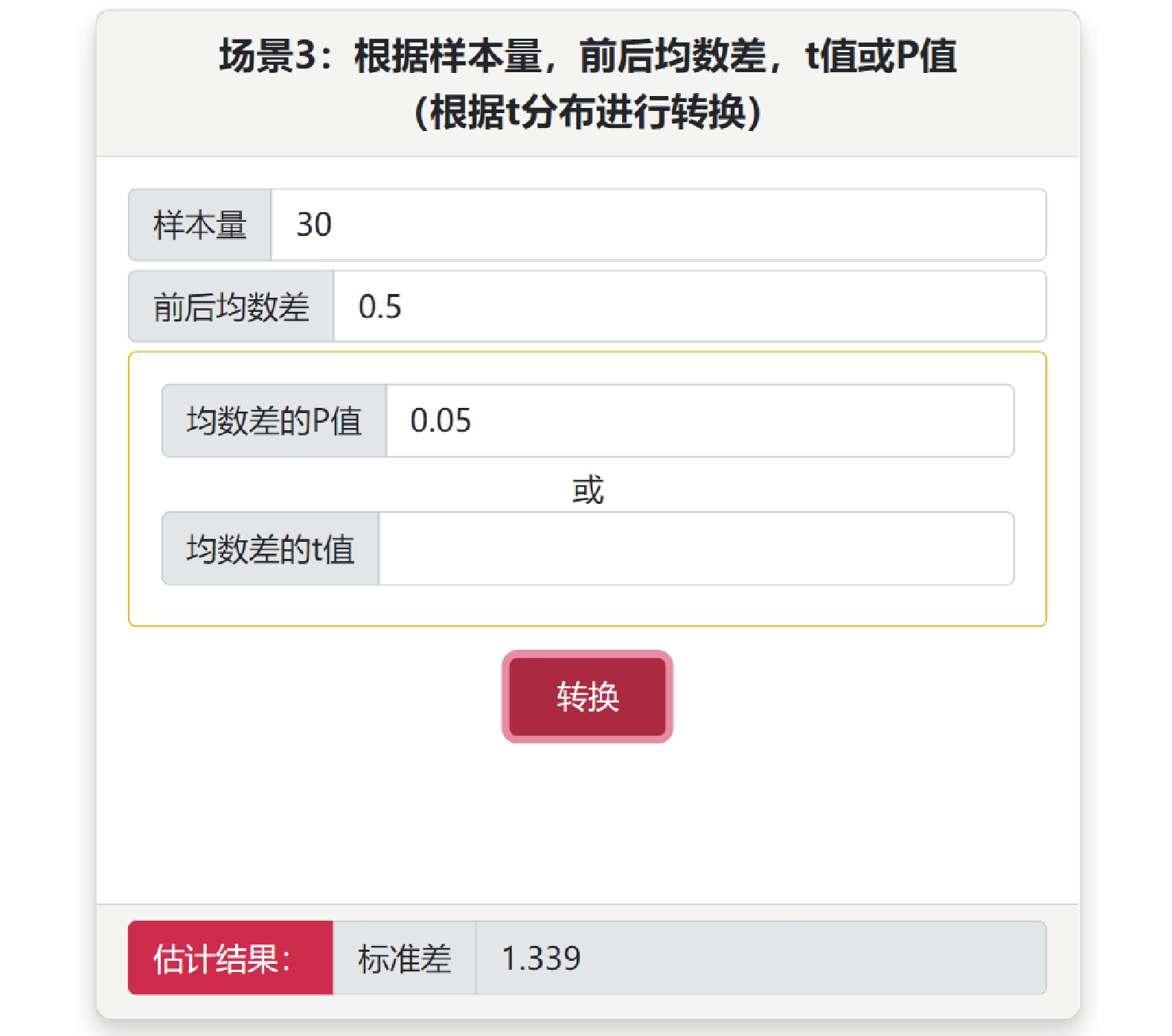
使用連續變量的效應指標進行Meta分析時,一般需要輸入均數、標準差和樣本量,但很多文獻可能提供的是可信區間和P值等,可采用“不同信息轉換成標準差”子菜單中5個場景,根據研究設計類型(配對設計和成組設計)和已知信息選擇合適場景計算標準差。例如某配對設計研究,已知信息樣本量為30,前后均數差為0.5,P值等于0.02,則選擇場景3,輸入數據后點擊轉換,得到標準差為1.11(圖2)。
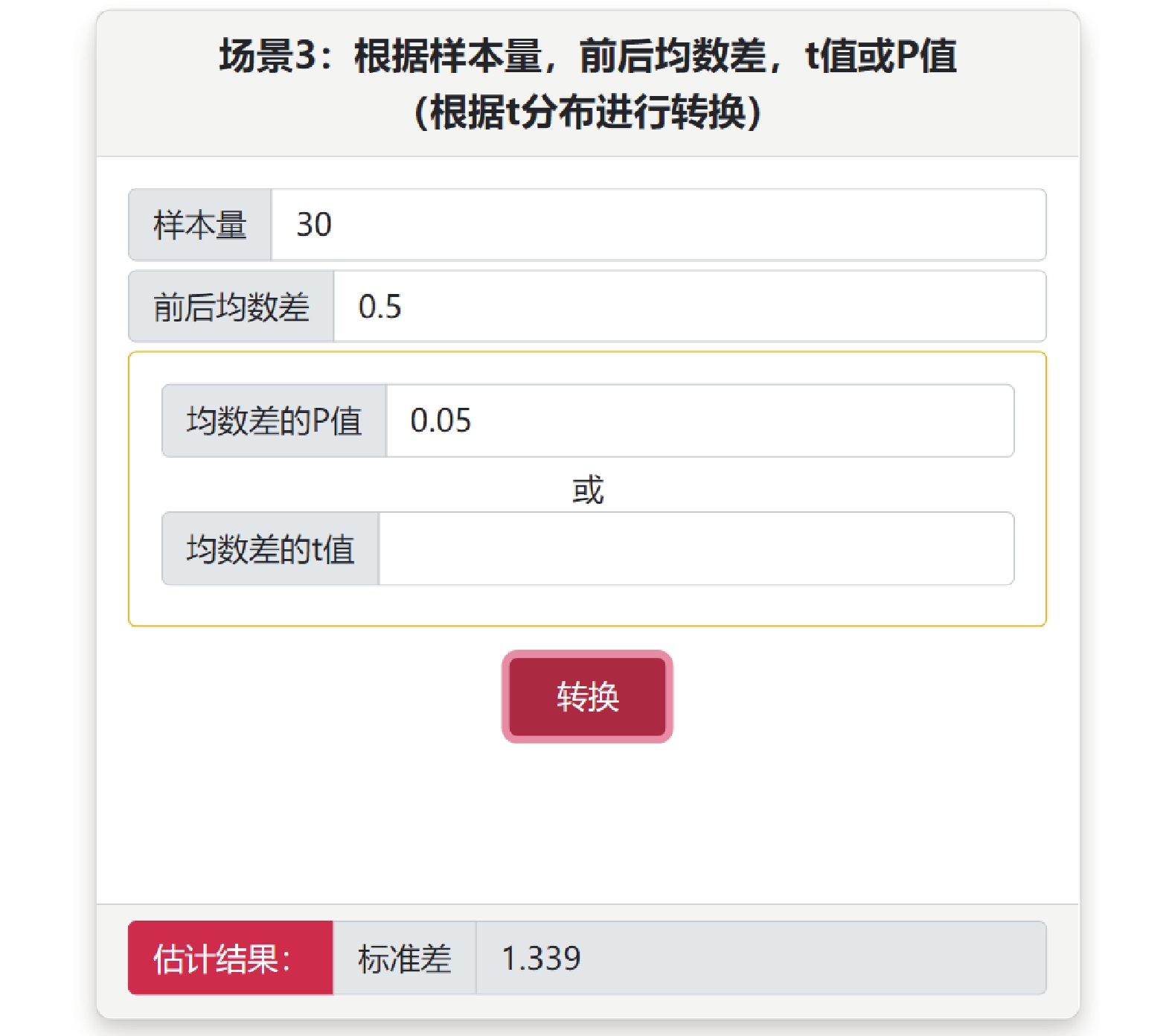 圖2
不同信息轉換成標準差(場景3)
圖2
不同信息轉換成標準差(場景3)
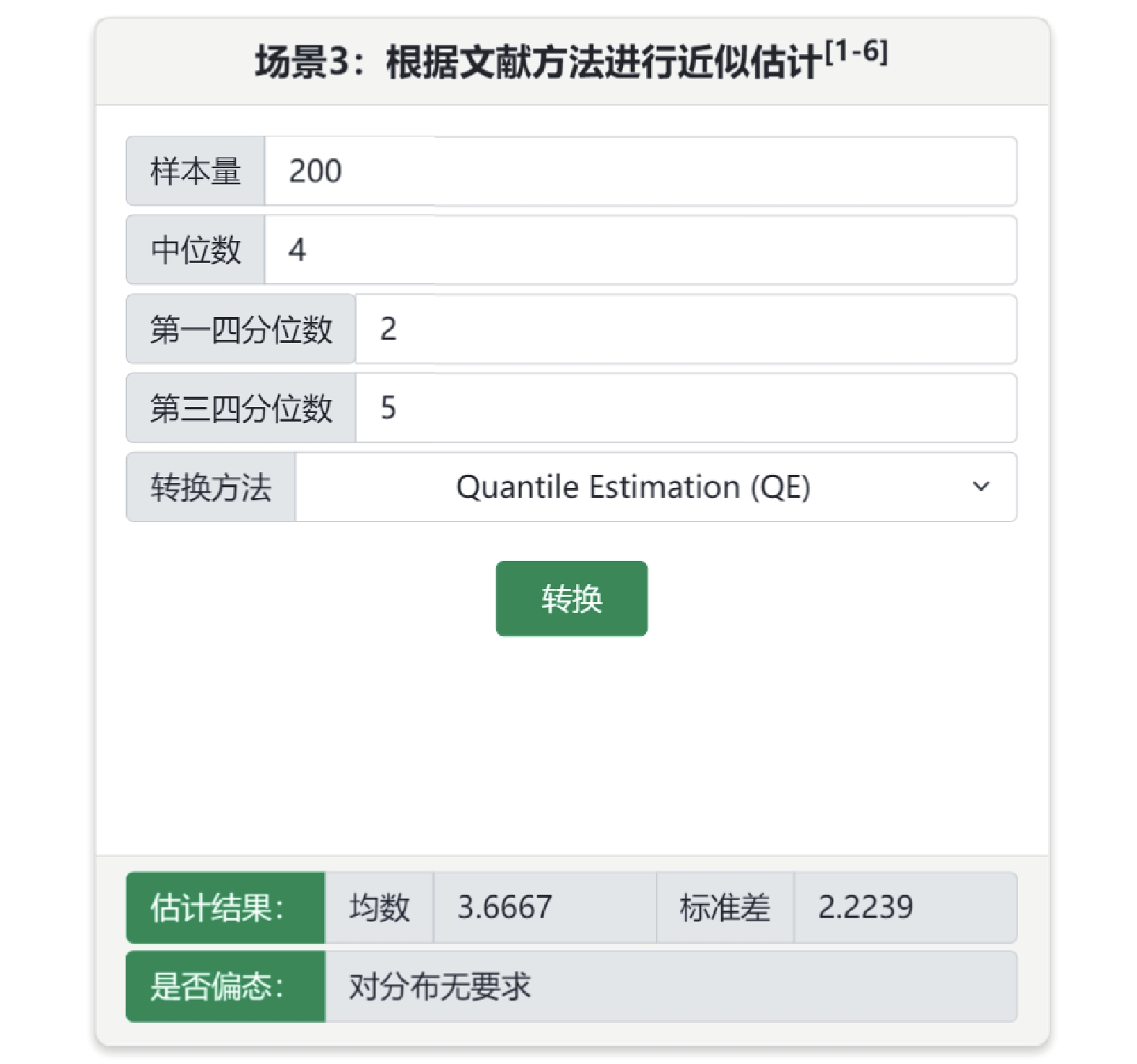
偏態分布的連續性變量常采用中位數(四分位間距)或中位數(第一四分位數,第三四分位數)進行描述,當納入的文獻中較多采用中位數等描述信息,可采用基于中位數為效應指標的Meta分析[2]。此外,可將中位數等信息近似轉換成均數和標準差用于Meta合并,童鐵軍等[3]提出的轉換方法建立在正態性假定下,為解決偏態分布下的近似轉換,McGrath等[4]提出了基于Box-Cox變換方法和quantile estimation(QE)法,Cai等[5]提出基于未知的非正態分布的轉換方法。在“中位數信息轉換成均數±標準差”子菜單可實現這4種轉換方法。例如某研究納入200例患者,住院天數的中位數為4,第一四分位數為2,第三四分位數為5,可選擇場景3,選擇QE法轉換為均值為3.67,標準差為2.22,見圖3。
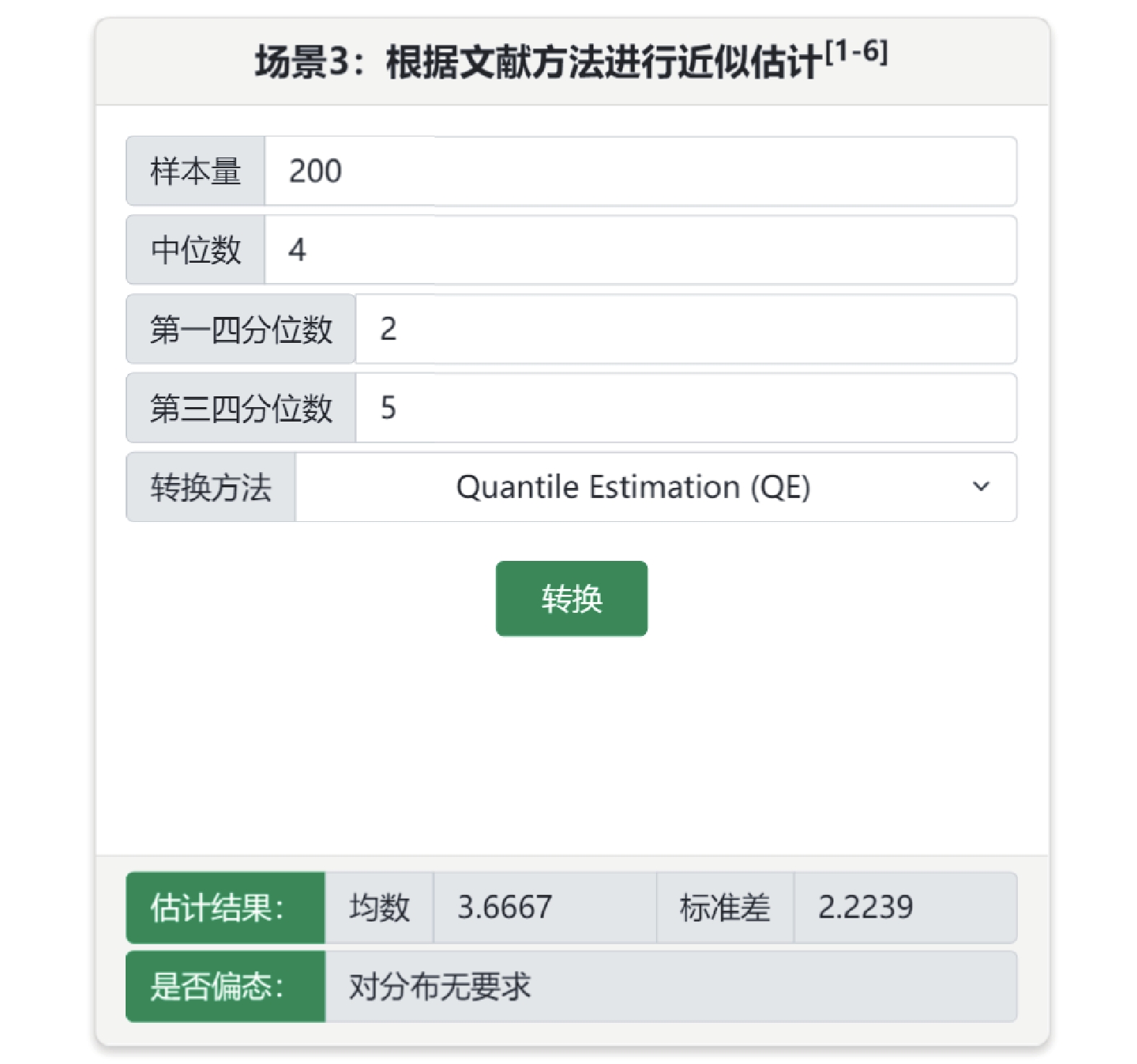 圖3
中位數信息轉換成均數±標準差(場景3)
圖3
中位數信息轉換成均數±標準差(場景3)
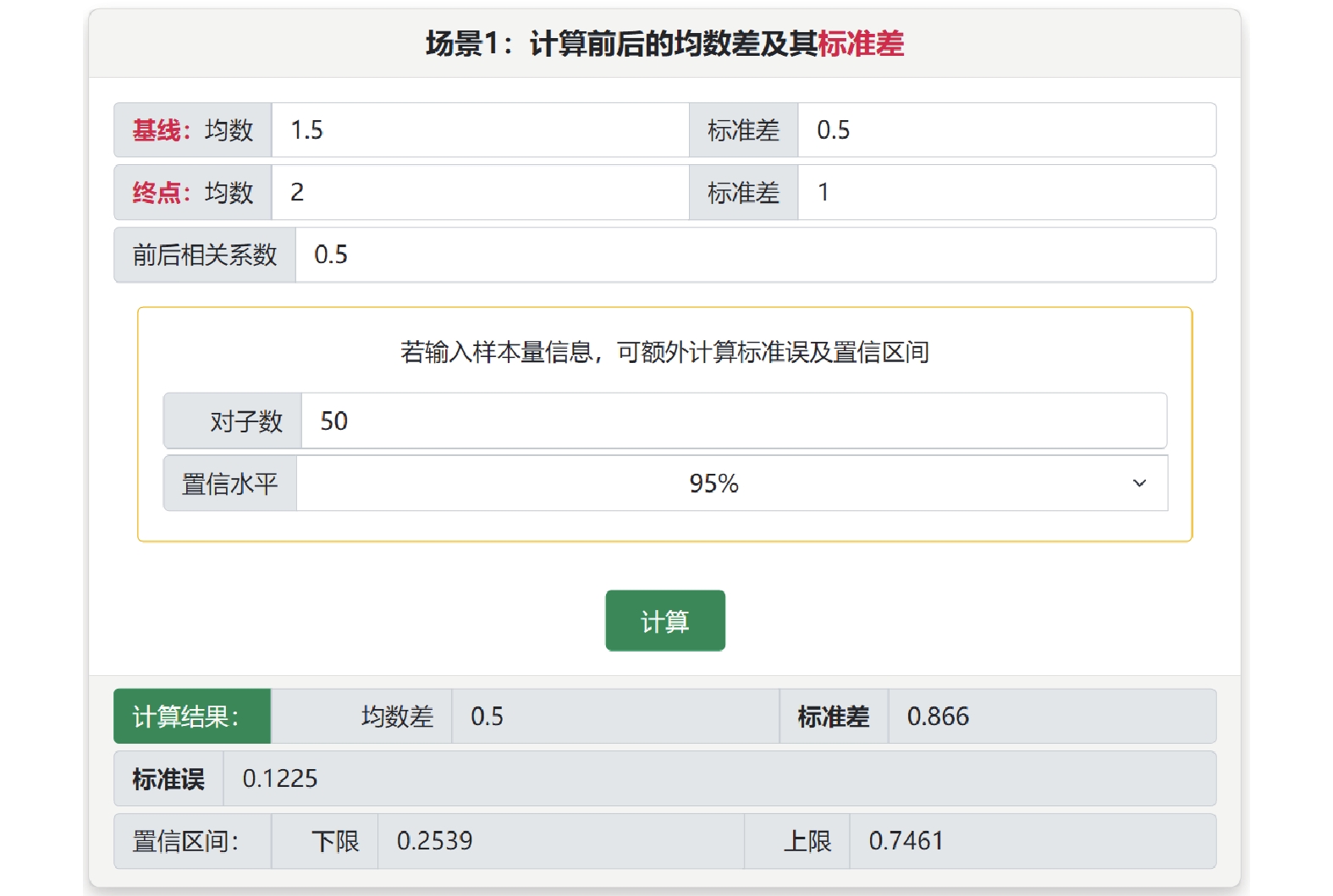
基于成組設計的轉換有3個子菜單。在“合并組間均數差及標準差”中可實現不同亞組的均數和標準差的合并。在“轉換為組間均數差和標準誤”子菜單中,場景1中可通過各組的樣本量、均數和標準差計算組間均數差和標準誤(或可信區間),場景2中可使用匯報的組間均數差及其P值估計標準誤(或可信區間),轉換結果可用于效應量的直接合并[6]。在“轉換成組間標準化均數差和標準誤”子菜單中,可使用原始均數差和標準差、回歸系數、點二列相關系數、t值或F值計算標準化均數差及其標準誤(或可信區間),并提供Cohens’d估計(標準計算)和Hedges’g估計(針對小樣本進行校正)兩種方法。基于配對設計的轉換有2個子菜單,分別用于計算均數差和標準化均數差及其標準差,在此計算中需要提供對子之間的相關系數,常取0.4或0.5。例如某個研究采用前后配對設計,共納入50例受試者,報告干預前均數為1.5±0.5,干預后2±1,估計前后相關系數為0.5,選擇“配對設計計算均數和標準差”子菜單中的場景1,可估計均數差為0.5±0.87,95%可信區間為(0.25,0.75)(圖4)。
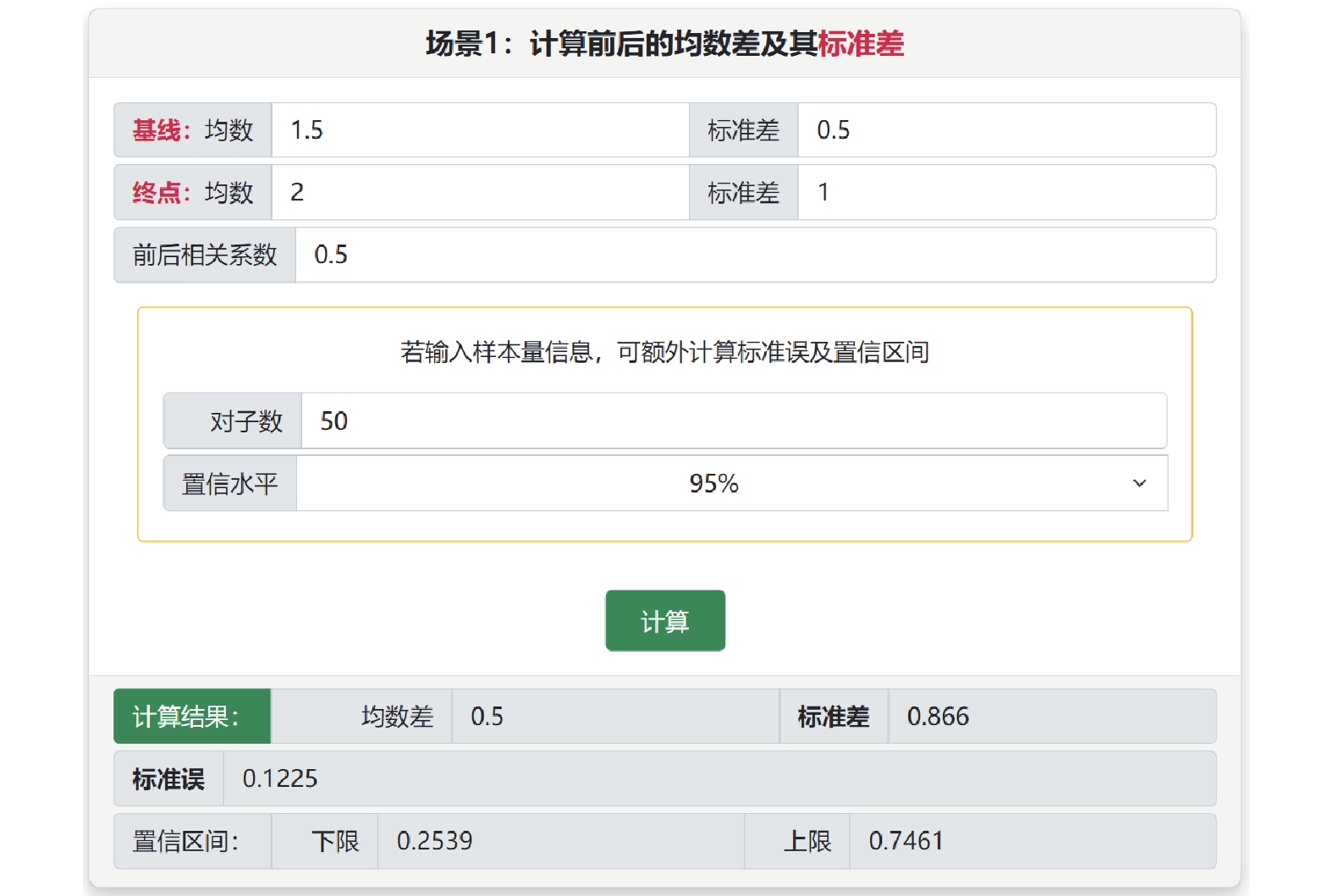 圖4
配對設計計算均數和標準差(場景1)
圖4
配對設計計算均數和標準差(場景1)
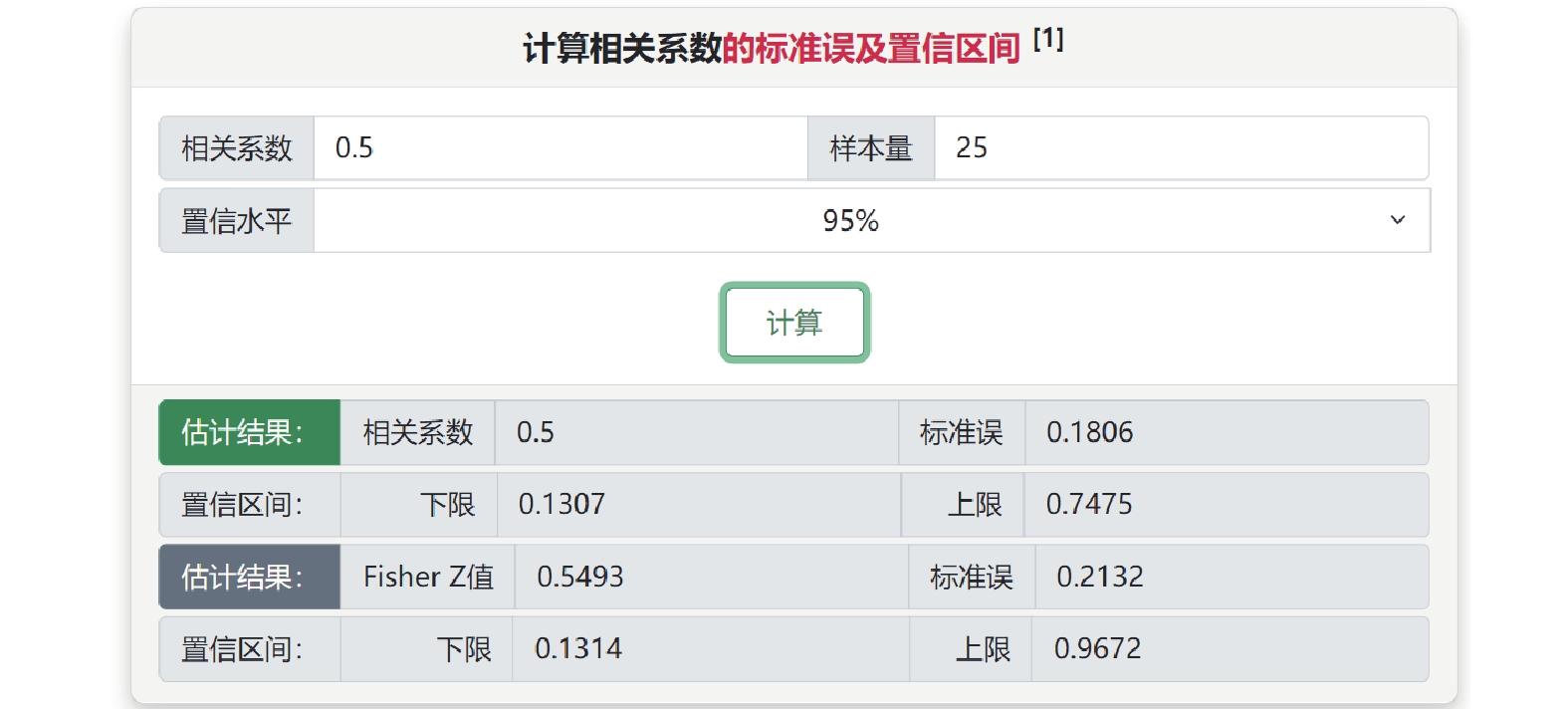
最后,在“相關系數和Fisher’ Z值及其轉換”子菜單中,可根據相關系數和樣本量計算其標準誤和Fisher’ Z值及其可信區間。此外,根據兩獨立樣本t檢驗的t值或P值,或者標準化均數差及其標準誤估計點二列相關系數[7]。例如某個研究中,僅報告樣本量為25和相關系數為0.5,可選擇場景1計算其標準誤及其可信區間(圖5)。
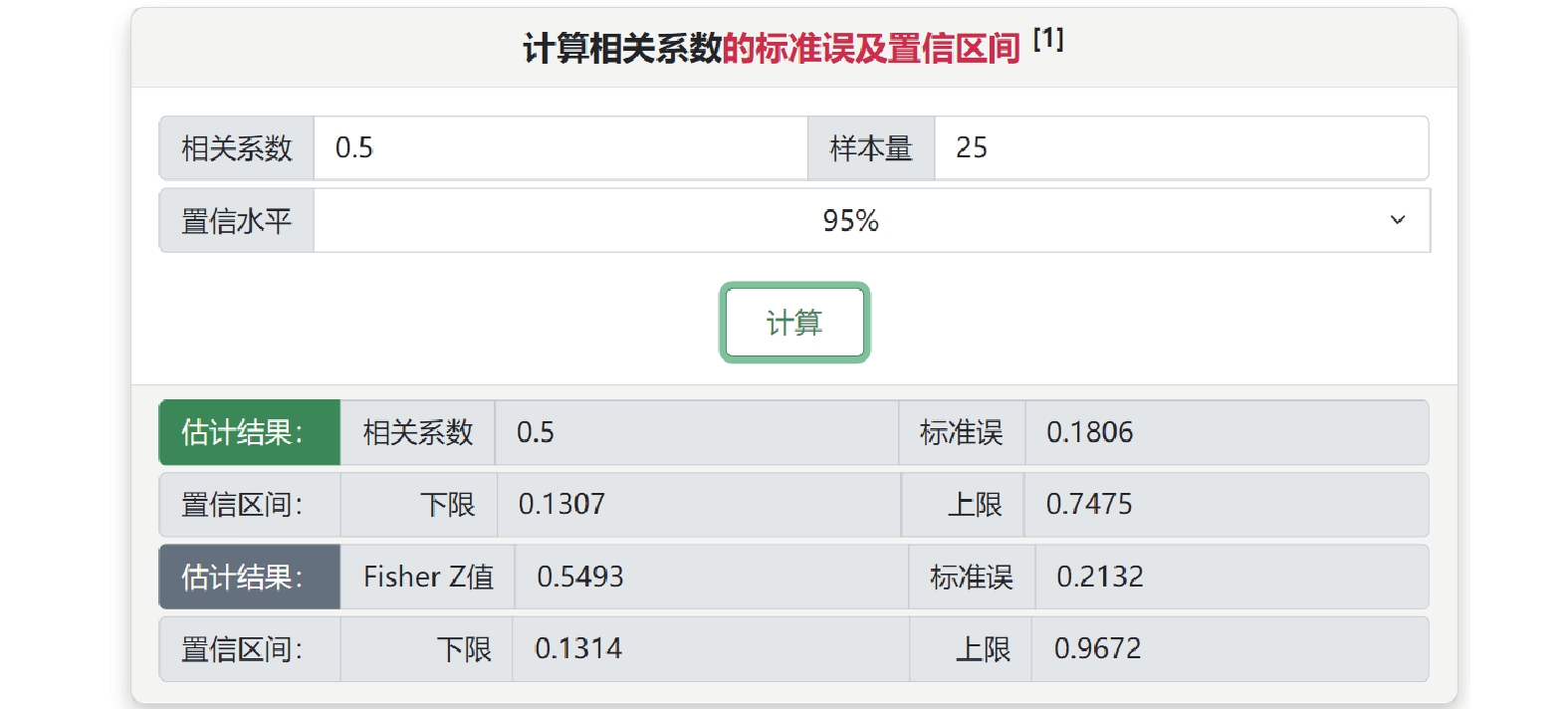 圖5
相關系數和Fisher’ Z值及其轉換
圖5
相關系數和Fisher’ Z值及其轉換
1.3 分類(生存結局)的效應指標
當研究結局為分類變量或者時間-事件變量,需選擇二級菜單“分類(生存)變量效應指標”。當研究僅涉及單組時,可計算單組率,如發病率和患病率等。在“計算單組率及其可信區間”子菜單中,提供10種率及其可信區間計算方法[8]。當涉及兩組時,資料常整理成四格表形式,可在“計算四格表中OR或RR”子菜單中計算OR、RR和危險度差。設計為診斷試驗時,結局可整理成四格表資料,在“計算診斷準確性試驗的效應指標”子菜單中,可計算診斷準確性評價指標(靈敏度、漏診率、特異度、誤診率)、臨床價值評價指標(陽性預測值、陰性預測值)、綜合評價指標(準確度、診斷OR、陽性似然比和陰性似然比)和貝葉斯指標(驗前概率、驗后陽性概率和驗后陰性概率),此外,還提供一致性評價指標Kappa值和McNemar一致性檢驗。
RR是前瞻性研究中常用的效應指標。在某些前瞻性研究中,可能會采用OR作為效應指標,此時選擇“OR轉換為RR”子菜單(共3個轉換場景)。或者,在前瞻性研究中選擇HR作為效應指標,可選擇“HR轉換為RR”子菜單(共5個轉換場景)。例如某個研究匯報HR為0.5,估計對照組隨訪末期事件發生率為20%,為轉換為RR進行Meta合并,可選擇場景2,計算可得RR為0.53。可信區間的轉換可分別輸入完成轉換(圖6)。
 圖6
風險比轉換為相對危險度(場景2)
圖6
風險比轉換為相對危險度(場景2)
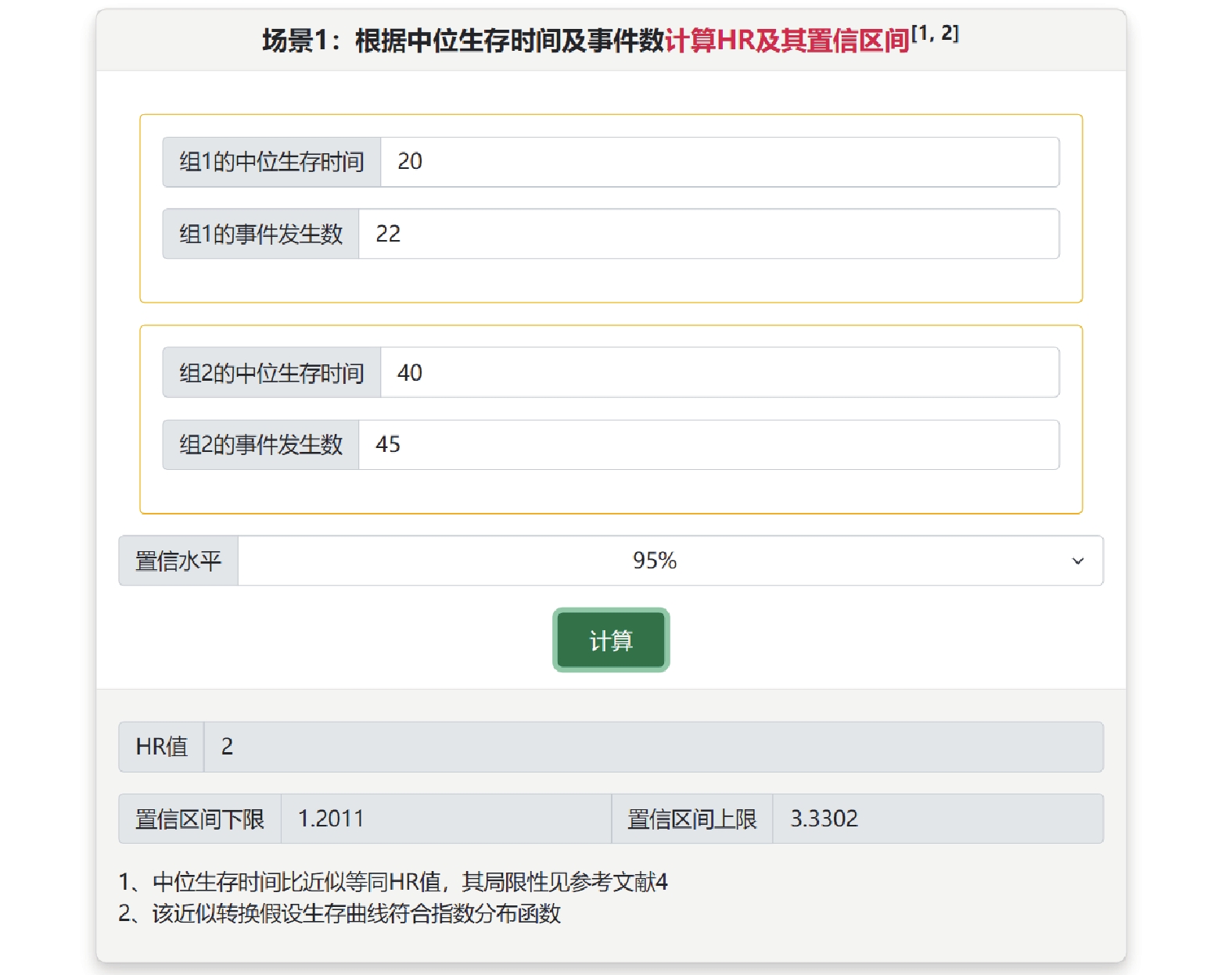
在生存結局的系統評價/Meta分析中,HR及其95%可信區間是最適宜進行合并的效應量。有些原始研究并未報告所需的完整信息,但大多數文獻會提供生存曲線。根據生存曲線中的信息進行合理的計算,可估計HR及其95%可信區間,用于Meta合并[9]。在“從生存曲線中估計HR及其可信區間”子菜單中提供所需的軟件、數據提取操作步驟和轉換的視頻教程。此外,可從文獻中提取中位生存時間、事件發生數和隨訪人年數等信息估計HR(“從生存數據的其他信息估計HR值”子菜單)。例如某研究報告兩組的中位生存時間為20和40,事件發生數為22和45,可在場景1中計算HR為2,95%可信區間為(1.20,3.33)(圖7)。
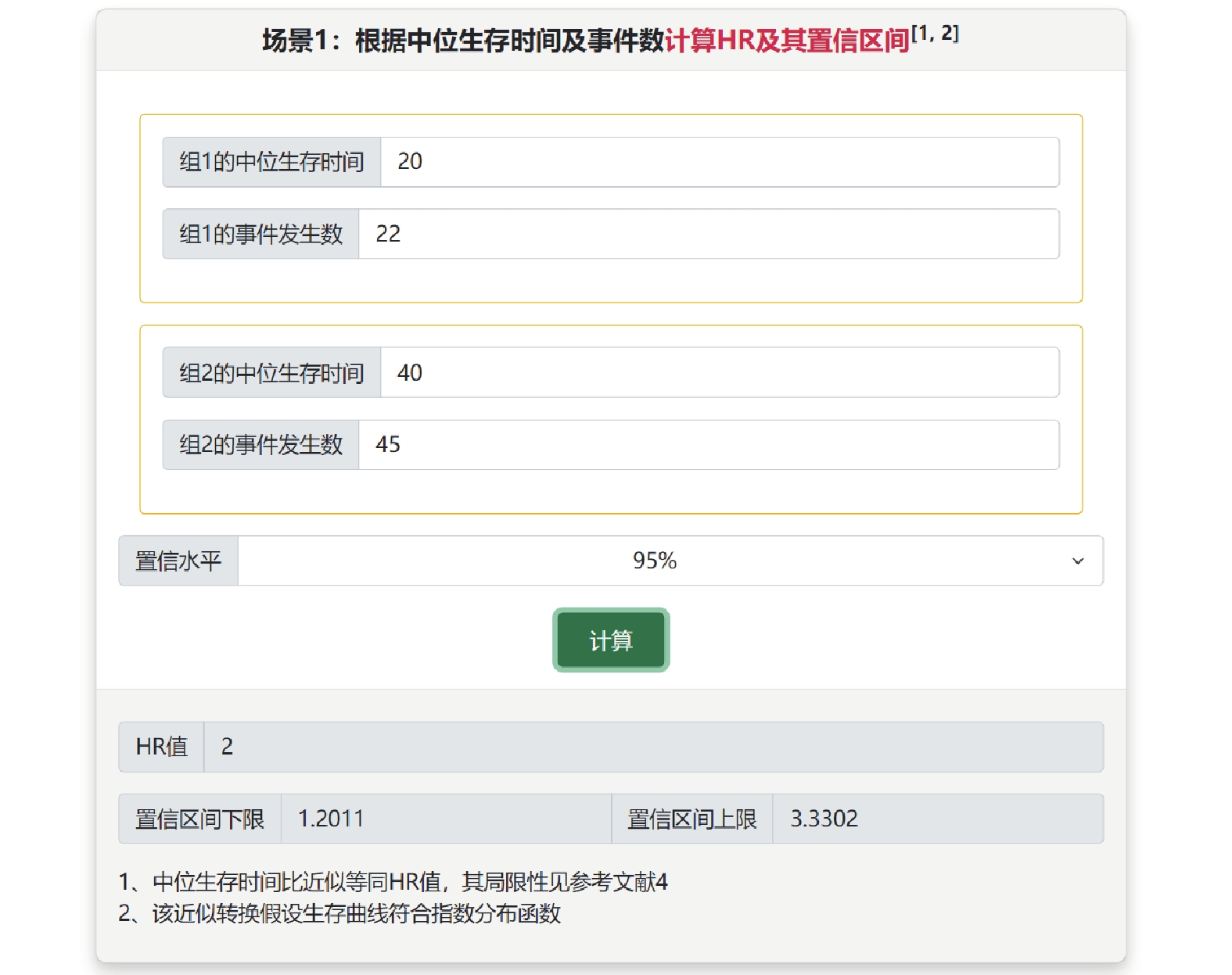 圖7
從生存數據的其他信息估計風險比值(場景1)
圖7
從生存數據的其他信息估計風險比值(場景1)
相對比指標在進行Meta合并時,是先將相對比轉換成回歸系數,再將回歸系數進行Meta合并,最后將回歸系數還原成相對比,用于解讀。在“回歸系數和相對比之間轉換及標準誤計算”子菜單中提供兩者之間的對數和指數轉換。
CONSORT報告規范(consolidated standards of reporting trials)和STROBE(strengthening the reporting of observational studies in epidemiology)常用于規范臨床研究的結果報告,二者均建議研究者同時報告相對指標和絕對指標。在“相對比指標估計絕對指標”子菜單中可實現將OR、RR和HR轉換成每1 000例中可減少或增加多少人發生結局。
1.4 不同類型的效應指標之間轉換
在數據滿足前提假設時,可在“不同類型間轉換”二級菜單中,實現不同類型的效應指標之間轉換。其中包括“標準化均數差與OR之間的轉換”、“標準化均數差估計RR”和“標準化均數差估計危險度差和NNT”三個子菜單。
例如,臨床醫生和患者決策時,需要評估選擇的治療比替代治療的優勢。當結局為分類變量時,可先計算危險度差,并將其轉換成NNT/NNH(number needed to treat/harm)。然而,當結局指標是連續性變量時,常使用標準化均數差,但臨床醫生和患者難以使用標準化均數差理解臨床效應的大小,可在“標準化均數差估計危險度差和NNT”子菜單中計算危險度差和NNT/NNH,用于臨床解讀。
2 循證過程工具箱
根據循證醫學研究的一般流程,在“循證研究”主菜單下集成“研究注冊平臺”,“循證常用數據庫導航”和“文獻評價和報告規范”3個二級菜單。
2.1 研究注冊平臺
臨床試驗注冊已成熟,在開展系統評價/Meta分析時,推薦提前將研究問題和研究方案在共享平臺進行公開和備案,可提高研究的透明化和規范性,同時減少發表偏倚和重復研究[10]。臨床實踐指南的計劃與注冊有助于指南制定過程高效、順利進行,規范促進指南項目組及其成員的工作并加強其責任感。在該二級菜單中納入系統評價/Meta分析(PROPOSE平臺、Cochrane協作網、INPLASY注冊平臺、JBI循證衛生保健中心、Campbell協作網、環境證據協作網)和臨床實踐指南(國際實踐指南注冊與透明化平臺PREPARE)注冊平臺,提供對應的注冊網址,并以圖文形式詳細說明了各個平臺的注冊步驟。
2.2 循證醫學研究常用數據庫導航
研究者在進行循證醫學研究的過程中,需要通過各類數據庫檢索相關文獻和臨床實踐指南。在“循證常用數據庫導航”二級菜單中,納入常用的中文數據庫(5個)、英文數據庫(9個)、中文臨床實踐指南數據庫(2個)和英文臨床實踐指南數據庫(10個)的導航。研究者可根據研究目的選擇指定數據庫,進行文獻檢索。
2.3 文獻評價和報告規范
文獻質量評價是循證醫學研究中必不可少的一環。Meta分析依賴于研究文獻本身的質量,需要對納入研究的質量進行準確而嚴格的評價,提高Meta分析結論的質量[11]。醫學研究論文長期處于增長趨勢中,醫學研究報告規范能為研究者在撰寫論文時提供簡明、結構化的信息清單,有效提高研究報告質量[12]。但不同類型的研究文獻有不同的質量評價工具和報告規范,量表數量和條目繁多,且絕大多數為英文量表。盡管國內很多學者已將其引入并進行解讀,但目前尚無學者同時對質量評價工具和報告規范按研究設計類型進行系統整理。在“文獻評價和報告規范”二級菜單中,已按照研究設計分類納入28個常用工具介紹(表1)。此外,該頁面也納入三個官方清單庫:JBI清單庫、CASP清單庫和國際醫療衛生研究的質量和透明化工作網。
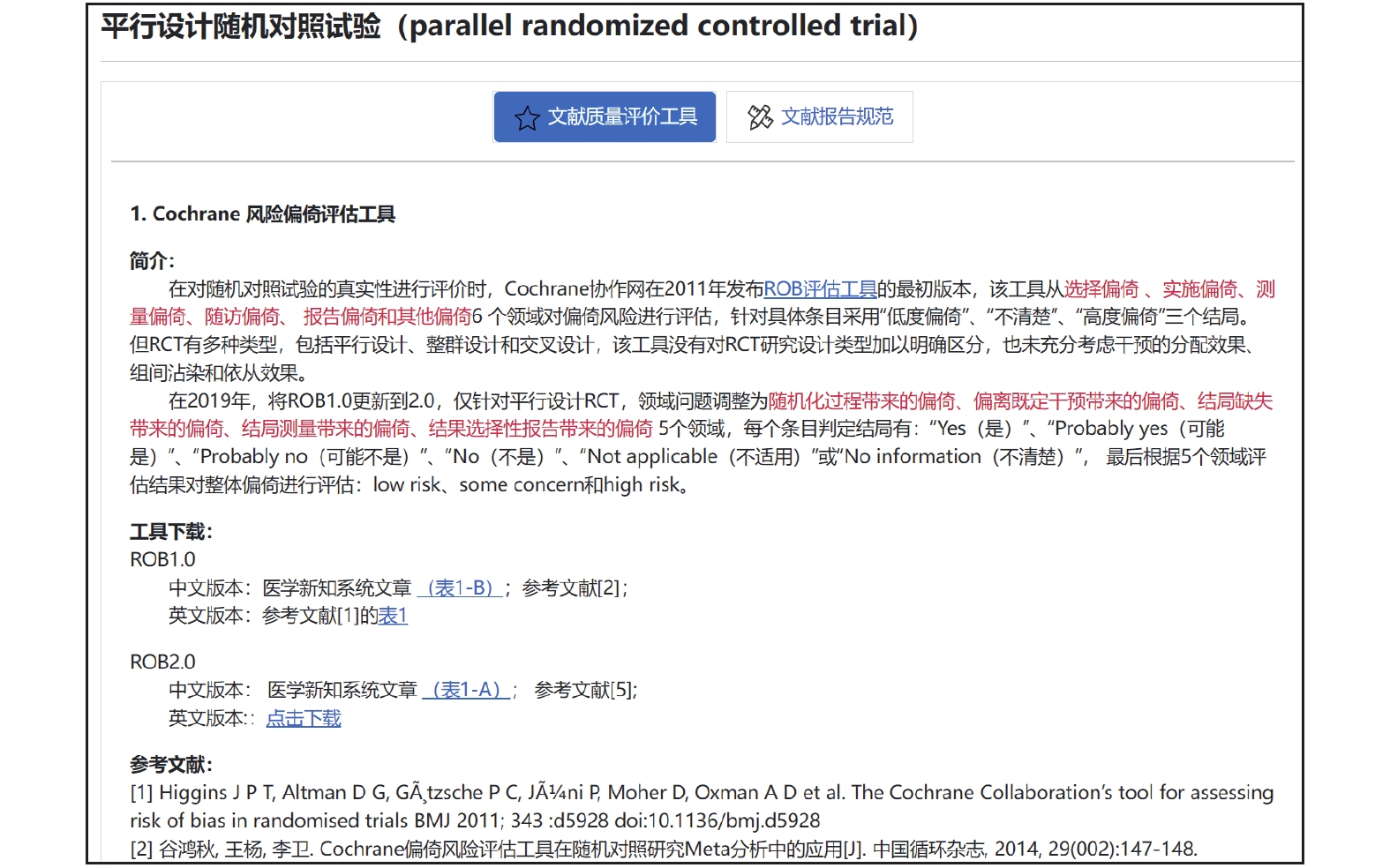
針對每個研究設計類型,設計獨立的文獻評價和報告規范介紹頁面,由工具簡介、下載地址(中英文版)和參考文獻(英文文獻和中文解讀文獻)三個部分構成。例如,研究設計類型為平行設計隨機對照試驗,則在“原始研究設計”中選擇對應的行,單擊即可跳轉到對應的工具介紹頁面(圖8)。
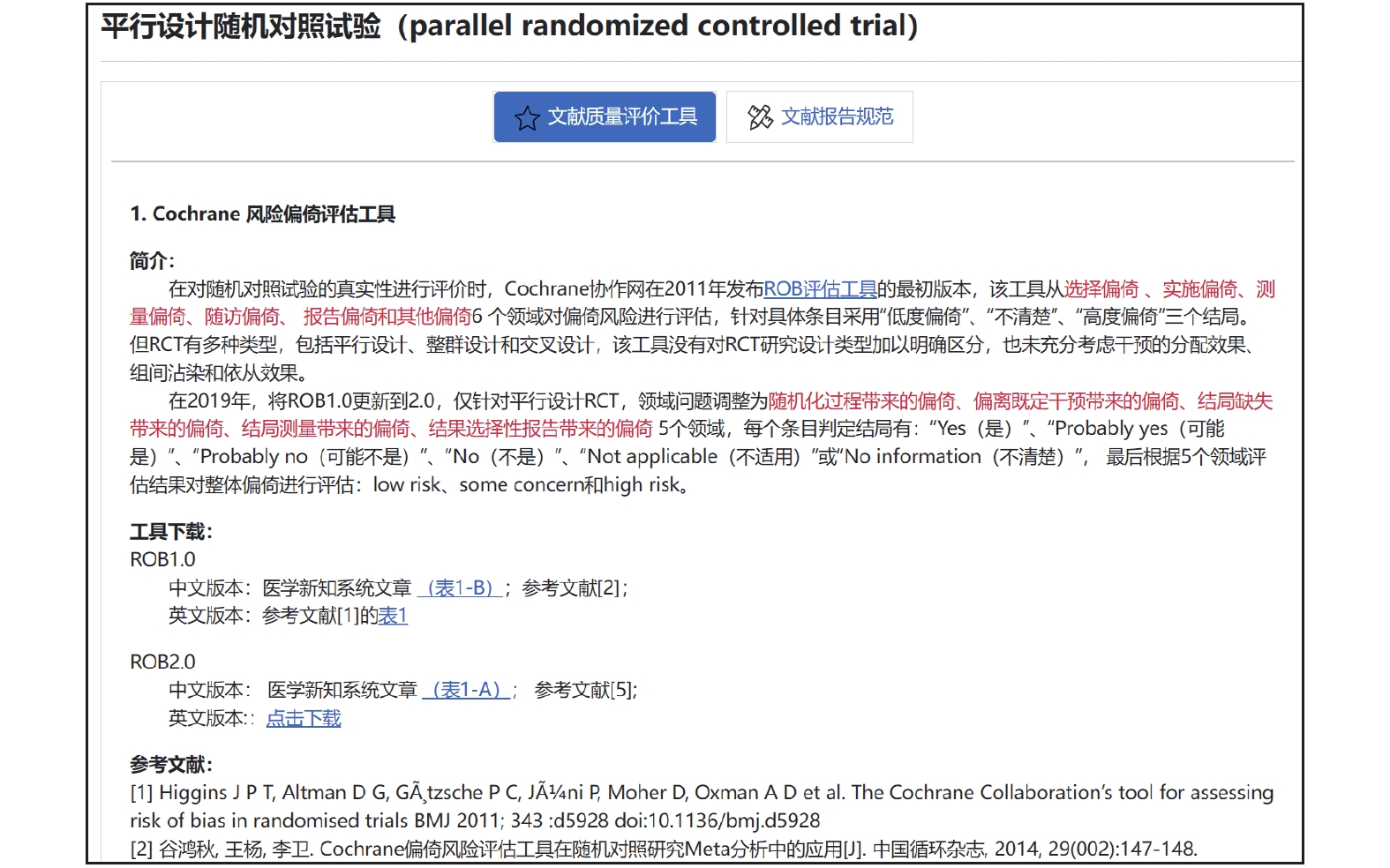 圖8
平行設計隨機對照試驗文獻質量評價工具和報告規范
圖8
平行設計隨機對照試驗文獻質量評價工具和報告規范
3 展望
循證醫學已成為醫學領域最具影響力的創新和革命之一,國際和國內的循證醫學已從生產證據過渡到使用證據,循證醫學會在未來得到進一步支持和關注[1,13]。循證醫學助手平臺目前可提供常用效應指標計算和轉換、注冊平臺簡介、常用數據庫導航和文獻質量評價和報告規范,但并未全面覆蓋循證醫學研究中全部需求,例如Meta分析中效應指標解讀、Meta分析方法學、數據提取輔助工具、在線評價工具系統、證據計算機化等,開發者未來將根據需求的優先級逐步增加更多功能,保持持續更新,爭做循證醫學發展道路上的好助手。
循證醫學是遵循證據的醫學,要求臨床醫生在對患者做出診治決策時盡可能慎重、準確和明智地應用最佳、最新的科學證據[1]。近幾年,循證醫學一直是醫學領城的研究熱點,但在開展循證醫學研究的不同階段,研究者往往會面臨各種問題。這一系列問題耗費研究者大量時間去查找資料,可能會影響循證醫學研究的順利展開。例如,在開展系統評價/Meta分析時,推薦提前將研究問題和研究方案在共享平臺進行公開和備案;確定臨床問題后,需要選擇合適數據庫進行有效且充分檢索;若進行Meta分析,在提取數據階段,納入文獻可能采用不同效應指標報告效應量,導致格式可能會不一致,需要進行恰當轉換才能導入軟件進行Meta合并;納入的文獻質量參差不齊,需要選擇恰當的工具進行質量評價;最后,在原始研究、系統評價和臨床實踐指南的寫作,推薦參考相應的報告規范進行完整描述,保證臨床研究結論的可靠性。
目前,國外研究者開發了系統評價加速器平臺(https://sr-accelerator.com/),為系統評價中的部分過程提供輔助工具,如文獻檢索式轉換(polyglot search)、文獻篩選(screenatron)和對比文獻篩選結果(disputatron),加速系統評價制作過程[2]。此外,Hannah將系統評價中使用的各類工具匯總,建立檢索平臺提供工具的跳轉(http://systematicreviewtools.com/)。但這兩個平臺均為英文,未收集效應指標的計算和轉換,且未整合中英文工具。依托循證與轉化中心的單位資源,結合多年循證研究和教學經驗,筆者采用前端(Html/CSS/JavaScript)、后端(PHP)和統計軟件(R)結合開發了本土的循證醫學研究助手,并在線發布在www.ebm-helper.cn。目前,該平臺包括四個模塊:指標計算和轉換模塊、循證醫學研究注冊平臺、循證醫學常用數據庫導航及常用文獻質量評價工具和報告規范。為幫助循證醫學研究者了解和使用平臺內容,本文對四個模塊進行詳細介紹。
1 指標計算和轉換模塊
納入原始研究在報告結果時采用的效應指標或數據格式可能會不一致,或未采用Meta分析常用軟件所需的格式,例如有些研究報告的是均數差和標準差,而有些研究采用均數差和對應的95%可信區間,需要將可信區間轉換成標準差,再輸入Meta分析軟件中。在預后研究中,部分文獻提供生存曲線,但未提供效應量風險比(hazard ratio,HR)及其可信區間。為盡可能保留更多有效的文獻數,可嘗試進行指標轉換,統一數據格式后再進行Meta分析。
經過前期文獻和書籍調研,在“指標計算和轉換”模塊中納入了46個場景的計算。選擇導航欄中“指標計算和轉換”菜單,按照變量類和目的分設有4個子菜單。研究者在使用時應注意每個場景要求的結局指標類型、效應指標類型和注意事項說明,此外,可參考每個場景計算提供的參考文獻,了解計算和轉換的原理。
1.1 效應指標轉換地圖
見圖1。連續變量結局的效應指標包括均數差、標準化均數差和相關系數(藍色區域)。分類(生存)變量結局的效應指標包括比值比(odds ratio,OR)、相對危險度(relative risk,RR)、危險度差和HR。該頁面將不同的效應指標之間可能的轉換關系進行整合,每個箭頭上的數字配有相應的鏈接,可跳轉至相應頁面完成計算和轉換。特別注意,不同類型結局的效應指標之間的轉換,需嚴格遵守前提假設進行。
 圖1
效應指標轉換關系
圖1
效應指標轉換關系
1.2 連續變量結局的效應指標
使用連續變量的效應指標進行Meta分析時,一般需要輸入均數、標準差和樣本量,但很多文獻可能提供的是可信區間和P值等,可采用“不同信息轉換成標準差”子菜單中5個場景,根據研究設計類型(配對設計和成組設計)和已知信息選擇合適場景計算標準差。例如某配對設計研究,已知信息樣本量為30,前后均數差為0.5,P值等于0.02,則選擇場景3,輸入數據后點擊轉換,得到標準差為1.11(圖2)。
 圖2
不同信息轉換成標準差(場景3)
圖2
不同信息轉換成標準差(場景3)
偏態分布的連續性變量常采用中位數(四分位間距)或中位數(第一四分位數,第三四分位數)進行描述,當納入的文獻中較多采用中位數等描述信息,可采用基于中位數為效應指標的Meta分析[2]。此外,可將中位數等信息近似轉換成均數和標準差用于Meta合并,童鐵軍等[3]提出的轉換方法建立在正態性假定下,為解決偏態分布下的近似轉換,McGrath等[4]提出了基于Box-Cox變換方法和quantile estimation(QE)法,Cai等[5]提出基于未知的非正態分布的轉換方法。在“中位數信息轉換成均數±標準差”子菜單可實現這4種轉換方法。例如某研究納入200例患者,住院天數的中位數為4,第一四分位數為2,第三四分位數為5,可選擇場景3,選擇QE法轉換為均值為3.67,標準差為2.22,見圖3。
 圖3
中位數信息轉換成均數±標準差(場景3)
圖3
中位數信息轉換成均數±標準差(場景3)
基于成組設計的轉換有3個子菜單。在“合并組間均數差及標準差”中可實現不同亞組的均數和標準差的合并。在“轉換為組間均數差和標準誤”子菜單中,場景1中可通過各組的樣本量、均數和標準差計算組間均數差和標準誤(或可信區間),場景2中可使用匯報的組間均數差及其P值估計標準誤(或可信區間),轉換結果可用于效應量的直接合并[6]。在“轉換成組間標準化均數差和標準誤”子菜單中,可使用原始均數差和標準差、回歸系數、點二列相關系數、t值或F值計算標準化均數差及其標準誤(或可信區間),并提供Cohens’d估計(標準計算)和Hedges’g估計(針對小樣本進行校正)兩種方法。基于配對設計的轉換有2個子菜單,分別用于計算均數差和標準化均數差及其標準差,在此計算中需要提供對子之間的相關系數,常取0.4或0.5。例如某個研究采用前后配對設計,共納入50例受試者,報告干預前均數為1.5±0.5,干預后2±1,估計前后相關系數為0.5,選擇“配對設計計算均數和標準差”子菜單中的場景1,可估計均數差為0.5±0.87,95%可信區間為(0.25,0.75)(圖4)。
 圖4
配對設計計算均數和標準差(場景1)
圖4
配對設計計算均數和標準差(場景1)
最后,在“相關系數和Fisher’ Z值及其轉換”子菜單中,可根據相關系數和樣本量計算其標準誤和Fisher’ Z值及其可信區間。此外,根據兩獨立樣本t檢驗的t值或P值,或者標準化均數差及其標準誤估計點二列相關系數[7]。例如某個研究中,僅報告樣本量為25和相關系數為0.5,可選擇場景1計算其標準誤及其可信區間(圖5)。
 圖5
相關系數和Fisher’ Z值及其轉換
圖5
相關系數和Fisher’ Z值及其轉換
1.3 分類(生存結局)的效應指標
當研究結局為分類變量或者時間-事件變量,需選擇二級菜單“分類(生存)變量效應指標”。當研究僅涉及單組時,可計算單組率,如發病率和患病率等。在“計算單組率及其可信區間”子菜單中,提供10種率及其可信區間計算方法[8]。當涉及兩組時,資料常整理成四格表形式,可在“計算四格表中OR或RR”子菜單中計算OR、RR和危險度差。設計為診斷試驗時,結局可整理成四格表資料,在“計算診斷準確性試驗的效應指標”子菜單中,可計算診斷準確性評價指標(靈敏度、漏診率、特異度、誤診率)、臨床價值評價指標(陽性預測值、陰性預測值)、綜合評價指標(準確度、診斷OR、陽性似然比和陰性似然比)和貝葉斯指標(驗前概率、驗后陽性概率和驗后陰性概率),此外,還提供一致性評價指標Kappa值和McNemar一致性檢驗。
RR是前瞻性研究中常用的效應指標。在某些前瞻性研究中,可能會采用OR作為效應指標,此時選擇“OR轉換為RR”子菜單(共3個轉換場景)。或者,在前瞻性研究中選擇HR作為效應指標,可選擇“HR轉換為RR”子菜單(共5個轉換場景)。例如某個研究匯報HR為0.5,估計對照組隨訪末期事件發生率為20%,為轉換為RR進行Meta合并,可選擇場景2,計算可得RR為0.53。可信區間的轉換可分別輸入完成轉換(圖6)。
 圖6
風險比轉換為相對危險度(場景2)
圖6
風險比轉換為相對危險度(場景2)
在生存結局的系統評價/Meta分析中,HR及其95%可信區間是最適宜進行合并的效應量。有些原始研究并未報告所需的完整信息,但大多數文獻會提供生存曲線。根據生存曲線中的信息進行合理的計算,可估計HR及其95%可信區間,用于Meta合并[9]。在“從生存曲線中估計HR及其可信區間”子菜單中提供所需的軟件、數據提取操作步驟和轉換的視頻教程。此外,可從文獻中提取中位生存時間、事件發生數和隨訪人年數等信息估計HR(“從生存數據的其他信息估計HR值”子菜單)。例如某研究報告兩組的中位生存時間為20和40,事件發生數為22和45,可在場景1中計算HR為2,95%可信區間為(1.20,3.33)(圖7)。
 圖7
從生存數據的其他信息估計風險比值(場景1)
圖7
從生存數據的其他信息估計風險比值(場景1)
相對比指標在進行Meta合并時,是先將相對比轉換成回歸系數,再將回歸系數進行Meta合并,最后將回歸系數還原成相對比,用于解讀。在“回歸系數和相對比之間轉換及標準誤計算”子菜單中提供兩者之間的對數和指數轉換。
CONSORT報告規范(consolidated standards of reporting trials)和STROBE(strengthening the reporting of observational studies in epidemiology)常用于規范臨床研究的結果報告,二者均建議研究者同時報告相對指標和絕對指標。在“相對比指標估計絕對指標”子菜單中可實現將OR、RR和HR轉換成每1 000例中可減少或增加多少人發生結局。
1.4 不同類型的效應指標之間轉換
在數據滿足前提假設時,可在“不同類型間轉換”二級菜單中,實現不同類型的效應指標之間轉換。其中包括“標準化均數差與OR之間的轉換”、“標準化均數差估計RR”和“標準化均數差估計危險度差和NNT”三個子菜單。
例如,臨床醫生和患者決策時,需要評估選擇的治療比替代治療的優勢。當結局為分類變量時,可先計算危險度差,并將其轉換成NNT/NNH(number needed to treat/harm)。然而,當結局指標是連續性變量時,常使用標準化均數差,但臨床醫生和患者難以使用標準化均數差理解臨床效應的大小,可在“標準化均數差估計危險度差和NNT”子菜單中計算危險度差和NNT/NNH,用于臨床解讀。
2 循證過程工具箱
根據循證醫學研究的一般流程,在“循證研究”主菜單下集成“研究注冊平臺”,“循證常用數據庫導航”和“文獻評價和報告規范”3個二級菜單。
2.1 研究注冊平臺
臨床試驗注冊已成熟,在開展系統評價/Meta分析時,推薦提前將研究問題和研究方案在共享平臺進行公開和備案,可提高研究的透明化和規范性,同時減少發表偏倚和重復研究[10]。臨床實踐指南的計劃與注冊有助于指南制定過程高效、順利進行,規范促進指南項目組及其成員的工作并加強其責任感。在該二級菜單中納入系統評價/Meta分析(PROPOSE平臺、Cochrane協作網、INPLASY注冊平臺、JBI循證衛生保健中心、Campbell協作網、環境證據協作網)和臨床實踐指南(國際實踐指南注冊與透明化平臺PREPARE)注冊平臺,提供對應的注冊網址,并以圖文形式詳細說明了各個平臺的注冊步驟。
2.2 循證醫學研究常用數據庫導航
研究者在進行循證醫學研究的過程中,需要通過各類數據庫檢索相關文獻和臨床實踐指南。在“循證常用數據庫導航”二級菜單中,納入常用的中文數據庫(5個)、英文數據庫(9個)、中文臨床實踐指南數據庫(2個)和英文臨床實踐指南數據庫(10個)的導航。研究者可根據研究目的選擇指定數據庫,進行文獻檢索。
2.3 文獻評價和報告規范
文獻質量評價是循證醫學研究中必不可少的一環。Meta分析依賴于研究文獻本身的質量,需要對納入研究的質量進行準確而嚴格的評價,提高Meta分析結論的質量[11]。醫學研究論文長期處于增長趨勢中,醫學研究報告規范能為研究者在撰寫論文時提供簡明、結構化的信息清單,有效提高研究報告質量[12]。但不同類型的研究文獻有不同的質量評價工具和報告規范,量表數量和條目繁多,且絕大多數為英文量表。盡管國內很多學者已將其引入并進行解讀,但目前尚無學者同時對質量評價工具和報告規范按研究設計類型進行系統整理。在“文獻評價和報告規范”二級菜單中,已按照研究設計分類納入28個常用工具介紹(表1)。此外,該頁面也納入三個官方清單庫:JBI清單庫、CASP清單庫和國際醫療衛生研究的質量和透明化工作網。
針對每個研究設計類型,設計獨立的文獻評價和報告規范介紹頁面,由工具簡介、下載地址(中英文版)和參考文獻(英文文獻和中文解讀文獻)三個部分構成。例如,研究設計類型為平行設計隨機對照試驗,則在“原始研究設計”中選擇對應的行,單擊即可跳轉到對應的工具介紹頁面(圖8)。
 圖8
平行設計隨機對照試驗文獻質量評價工具和報告規范
圖8
平行設計隨機對照試驗文獻質量評價工具和報告規范
3 展望
循證醫學已成為醫學領域最具影響力的創新和革命之一,國際和國內的循證醫學已從生產證據過渡到使用證據,循證醫學會在未來得到進一步支持和關注[1,13]。循證醫學助手平臺目前可提供常用效應指標計算和轉換、注冊平臺簡介、常用數據庫導航和文獻質量評價和報告規范,但并未全面覆蓋循證醫學研究中全部需求,例如Meta分析中效應指標解讀、Meta分析方法學、數據提取輔助工具、在線評價工具系統、證據計算機化等,開發者未來將根據需求的優先級逐步增加更多功能,保持持續更新,爭做循證醫學發展道路上的好助手。