引用本文: 王志超, 馮凡超, 顧誠, 彭文潘, 徐泳, 韓迪, 周賢梅. 內質網應激:特發性肺纖維化的潛在治療方向. 中國呼吸與危重監護雜志, 2020, 19(5): 520-527. doi: 10.7507/1671-6205.201905018 復制
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是最常見的特發性間質性肺炎,是一種慢性、進行性、不可逆性和致死性肺部疾病,多發于中老年男性,中位發病年齡為 65 歲。其病理學主要表現為胸膜下和基底部的纖維化與蜂窩樣改變,以及肺纖維化灶周圍的膠原和細胞外基質(extracellular matrix,ECM)沉積,最終導致肺組織結構改變,肺通氣和彌散功能喪失而危及生命。雖然 IPF 發病率極低,在歐洲和北美洲每 10 萬人中僅有 2.8~18 例 IPF 患者,在亞洲和南美洲每 10 萬人中僅有 0.5~4.2 例 IPF 患者[1],但隨著人口老齡化程度日益加深,流行病學調查顯示 IPF 發病率正在逐年升高[2]。IPF 的發病機制至今仍未完全明確,歷史上曾一度認為 IPF 是慢性炎性疾病,但隨著抗炎治療宣告失敗,專家們才開始重新評估其發病機制[1]。近年來,IPF 的發病機制正逐步被揭示,但是仍缺乏有效的治療手段,診斷后的中位生存期僅為 2~4 年[1]。
目前研究主要認為,基因突變和環境暴露是 IPF 的重要致病因素,其中基因突變主要包括 SFTPC、TOLLIP、TERT、TERC、MUC5B 等,環境暴露主要包括吸煙、粉塵、病毒等[1],這些因素都可以引起肺泡上皮細胞(alveolar epithelial cell,AEC)功能障礙,引發 AEC 內質網應激(endoplasmic reticulum stress,ERS),激活轉化生長因子-β(transforming growth factor-β,TGF-β)并分泌生長因子、趨化因子等,誘發上皮間質轉化(epithelial-mesenchymal transition,EMT),招募成纖維細胞和促進成纖維細胞分化,病理性間充質細胞繼而釋放大量 ECM,最終導致肺重塑和瘢痕肺[3]。因此,AEC 是 IPF 發生的關鍵因素,肺成纖維細胞是 IPF 發展的重要環節。除此之外,炎癥細胞也參與了 IPF 的發生發展,如巨噬細胞。AEC 又分為Ⅰ型肺泡上皮細胞(alveolar epithelial cell Ⅰ,AEC Ⅰ)和Ⅱ型肺泡上皮細胞(alveolar epithelial cell Ⅱ,AEC Ⅱ),其中 AEC Ⅱ是祖細胞,可以啟動肺泡上皮修復,產生新的 AEC Ⅱ或分化為 AEC Ⅰ,對于肺發育和再生至關重要[4-5]。而導致 AEC Ⅱ功能異常的重要因素之一即為 ERS。
內質網(endoplasmic reticulum,ER)是一種負責維持蛋白質穩態的細胞器。ER 的主要功能是蛋白折疊,并在蛋白到達其目標位置前對其進行質量控制。任何擾亂蛋白加工的條件都可能導致 ER 中錯誤折疊蛋白的積累,這種情況稱為 ERS。為了應對 ERS,細胞啟動一種信號級聯反應,稱為未折疊蛋白反應(unfold protein response,UPR)。UPR 最初旨在恢復蛋白穩態,但長期或嚴重的 ERS 卻可能導致細胞死亡[6]。慢性 ERS 是諸多疾病的主要病因,包括神經退行性疾病、糖尿病、癌癥和代謝性疾病[7]。目前證據表明 ERS/UPR 在腎臟、心臟、肝臟、胃腸道和肺等器官的纖維化中發揮關鍵作用[8]。2001 年研究首次發現 ERS 和 IPF 之間有潛在聯系,發現家族性 IPF 可能是由 AEC Ⅱ中的 SFTPC 突變引起[9],當 SFTPC 突變體在肺上皮細胞系中表達時,可以導致突變蛋白在 ER 中積累,從而使細胞發生 ERS[10-14]。之后更多研究表明,ERS 不論在家族性 IPF 還是在散發性 IPF 患者的肺部都普遍存在[12, 15]。本文重點介紹 ERS 在 IPF 中作用的進展。文中出現的基因或蛋白的英文縮寫詳見表 1。
1 ERS 和 UPR
每個細胞每分鐘可以產生幾百萬個蛋白質,其中至少三分之一是由 ER 來完成折疊和加工[16-17]。ER 主要功能包括蛋白質的合成、折疊、組裝和運輸,同時也負責對缺陷蛋白進行降解[18-21]。ER 中蛋白折疊是一個取決于多種因素的復雜過程[22-26],任何因素的擾動都可能導致 ERS,激活 UPR。
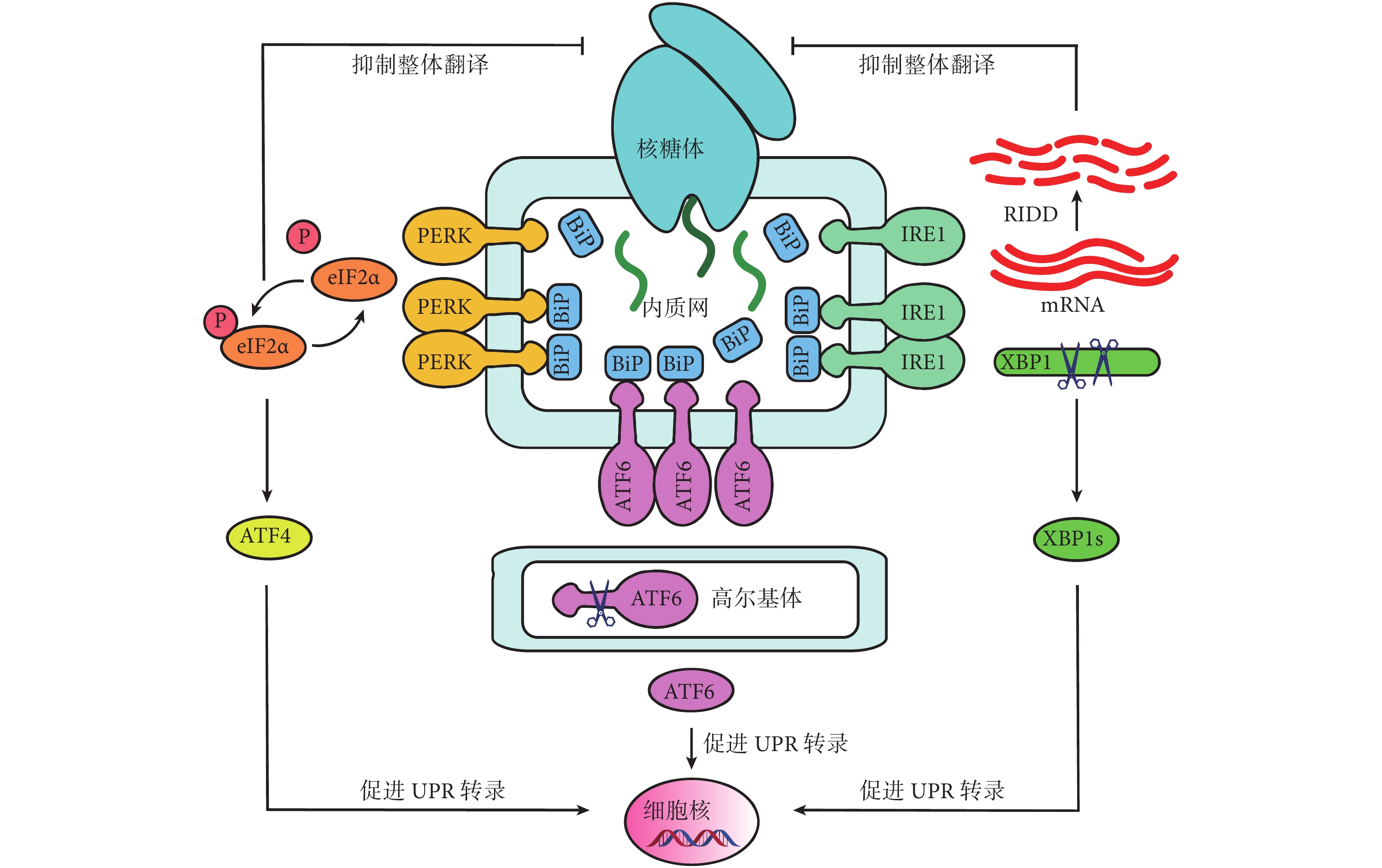
UPR 包含三種 ER 跨膜蛋白,分別是 PERK、ATF6 和 IRE1α,它們作為 ERS 傳感器,能夠激活下游通路,協調反應,保護細胞[18-19]。ER 伴侶蛋白 BiP 又稱 GRP78,屬于熱休克蛋白家族,在正常細胞中可以保持和 PERK、ATF6 和 IRE1α 的結合,保持傳感器處于非活動狀態。在發生 ERS 的細胞中,BiP 與傳感器解離,激活傳感器并啟動 UPR,一方面通過減少總蛋白翻譯以降低蛋白折疊負荷,另一方面通過增加關鍵伴侶蛋白和氧化還原蛋白的表達以增強內質網折疊蛋白的能力,兩方面共同作用以恢復細胞穩態(圖 1)[27-28]。
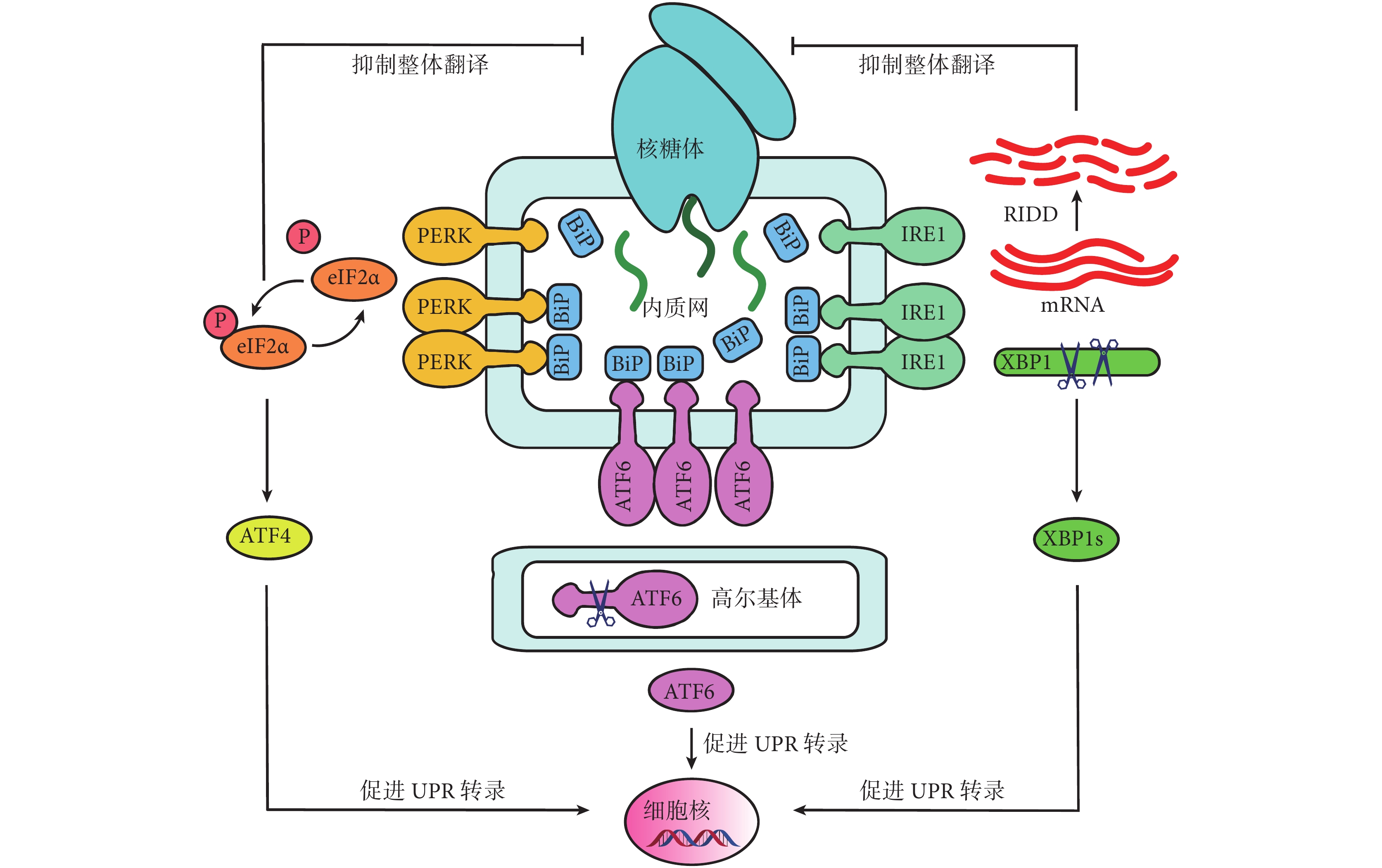 圖1
UPR 三條作用途徑
圖1
UPR 三條作用途徑
1.1 PERK 途徑
PERK 被激活后磷酸化 eIF2α,從而通過抑制核糖體組裝來整體抑制蛋白合成,同時還上調激活 ATF4,來誘導細胞穩態基因的表達,并激活 GADD34 和 CHOP 等促凋亡因子。另外,ATF4 亦可以誘導 ATF3 的表達,繼而通過結合組蛋白脫乙酰化酶抑制基因轉錄。
1.2 ATF6 途徑
ATF6 被釋放后轉移至高爾基體中被 site1 和 site2 蛋白酶水解為 NH2 端結構域和 ATF6p50。ATF6p50 又由細胞質轉運至細胞核,激活一系列 ER 蛋白的轉錄,如鈣網蛋白、PDI、CHOP 和 XBP1 的表達。
1.3 IRE1α 途徑
IRE1α 被激活后發生二聚磷酸化,將 XBP1 mRNA 中一段 26 bp 的內含子剪切并重組為活性形式 XBP1s,隨后作為許多應激蛋白的轉錄因子,擴大 ER 的蛋白質折疊能力,同時也通過 ERAD 等途徑促進錯誤折疊蛋白的降解及運輸,包括 EDEM。激活的 IRE1α 還可以通過 RIDD 過程降解一系列 mRNA,從而影響細胞存活和其他細胞表型。
2 影響 ERS 的因素
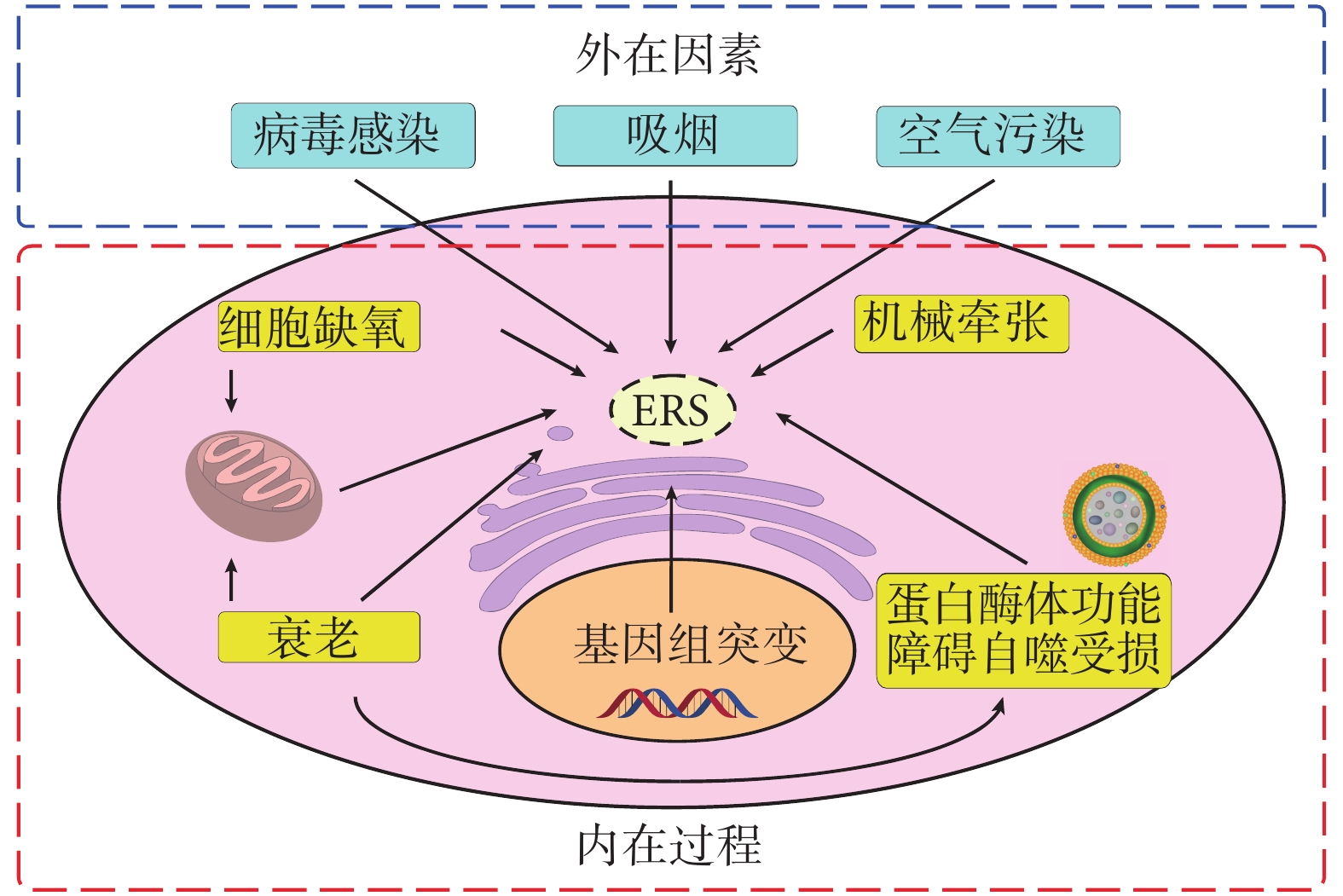
除了遺傳因素決定的突變蛋白的表達,ERS 還可以被其他因素誘導,主要分為外源因素和內源因素。外源因素有蛋白表達的升高(如病毒感染)、活性氧(reactive oxygen species,ROS)的產生以及氧化還原平衡的失調(如吸煙);而內源因素有生物能學的損害(如缺氧、衰老)、鈣離子的轉運(如機械牽張)以及錯誤折疊蛋白清除能力的減弱(如蛋白酶體功能障礙、自噬受損)(圖 2)。
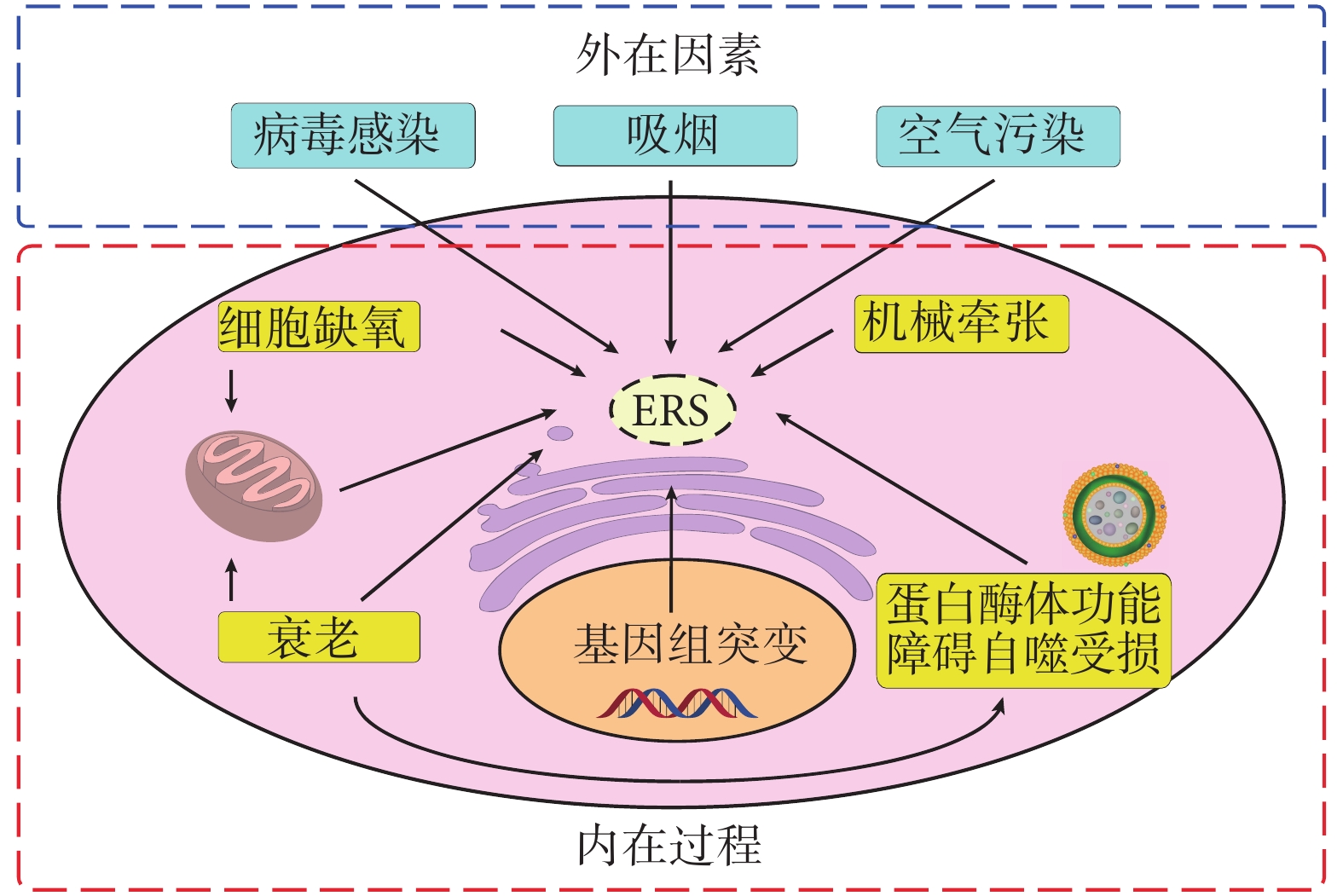 圖2
影響 ERS 的因素
圖2
影響 ERS 的因素
病毒感染可以引起 ERS,有研究團隊通過檢測 IPF 患者肺部的皰疹病毒抗原[29],證實在 IPF 患者[12]以及家族性 IPF 患者的無癥狀親屬[30]的 AEC 中,皰疹病毒抗原和 ERS 標志物同時表達,提示皰疹病毒誘導的 ERS 在肺纖維化中發揮一定作用。
缺氧也可以誘導 ERS,蛋白錯誤折疊主要是由于在蛋白不同區域間或相鄰蛋白間的相互作用,ER 中的很多伴侶蛋白可以降低這些相互作用,而伴侶蛋白活性依賴 ATP 水解來提供能量,這種能源依賴性導致缺氧、營養缺乏或代謝障礙的細胞中常常出現 ERS[23]。有研究報道 IPF 患者肺部缺氧相關基因組表達增加[31],IPF 患者 AEC 的單細胞測序也證明細胞缺氧的存在[32]。
衰老是另一種影響 ERS 的代表性因素,可以顯著損害 ER 功能,通過減少伴侶蛋白,增加畸形線粒體和減弱蛋白酶體降解[33-36]。有研究表明,在肺纖維化小鼠模型中,老年小鼠 AEC Ⅱ中的 ERS 標志物表達比年輕小鼠高[37],提示 ERS 和衰老之間存在一定的聯系。除了衰老的直接影響,損害的 ER 質量控制機制(如 ERAD、自噬)也可以導致 ERS[38-39]。自噬標志物 LC3-Ⅱ在纖維化區域的 AEC Ⅱ中不表達,而在非纖維化區域則高表達[39]。
3 ERS 調節的信號通路
ERS 和 UPR 信號通路與纖維化疾病相關聯,主要是通過細胞凋亡、成纖維細胞活化及分化、EMT 和炎癥反應激活及極化等機制[6, 8, 40]。
3.1 凋亡
在肺及許多其他臟器中,上皮細胞凋亡是纖維化疾病的關鍵因素[6]。長期或過度的 ERS 可通過幾種 UPR 下游機制誘導上皮細胞凋亡,其一是誘導 CHOP,其二是誘導 ER 結合 Caspase-4(小鼠中為 Caspase-12),其三是誘導 JNK[18-19, 21]。研究最廣泛也最成熟的是 CHOP,它是轉錄因子 C/EBP 家族成員,通過與增強子的相互作用,既可以作為 C/EBP 轉錄活性的抑制劑,也可以作為靶基因的激動劑[41]。CHOP 通過激活促凋亡基因和抑制抗凋亡基因(如 Bcl2)來調節細胞凋亡[42]。但同時,雖然 CHOP 主要在 PERK/ATF4 下游發揮作用,但 UPR 的三條途徑都可以參與誘導 CHOP[43]。ERS 還可以通過非 UPR 途徑引起細胞凋亡,比如在 ERS 過大時,通過 Bax 和 Bak 將鈣離子釋放到細胞質中,從而引發細胞凋亡[44]。
3.2 EMT
除了對細胞凋亡的影響,ERS 還可以影響細胞分化。如 XBP1 有助于漿細胞分化[45]。而在纖維化疾病中,ERS 可以促進成纖維細胞活化,并向肌成纖維細胞分化,產生大量膠原和 ECM。有研究顯示,成纖維細胞發生 ERS 后更易受 TGF-β 誘導分化為肌成纖維細胞[46]。而在上皮細胞中,ERS 則可誘導 EMT,雖有研究證實 EMT 不能將 AEC 轉化為肺成纖維細胞,但產生的細胞表型可直接參與纖維化重塑[11, 14, 47]。此外,環孢霉素可以通過誘導腎小管上皮細胞 ERS 發生 EMT[47]。
3.3 炎癥反應
炎癥也與纖維化有關。ERS 和 UPR 途徑被證實可以調節炎癥相關信號通路,其中包括 NF-κB 和 AP-1[48]。在炎性腸病的結腸黏膜中可以同時觀察到 ERS 和炎癥[49]。骨髓源性巨噬細胞經脂多糖刺激后產生的 ERS 能夠驅動 pro-IL-1β 的合成和加工[50]。
在不同病理生理學背景下,ERS 可能使巨噬細胞極化為 M1 型(促炎型)或 M2 型(促纖維化型)[51]。在肺纖維化[52]、糖尿病[53]和過敏性氣道炎癥[54]中,ERS 可以通過 JNK 或 CHOP 依賴性機制驅使巨噬細胞向 M2 型極化。
4 ERS 對不同細胞的促纖維化作用
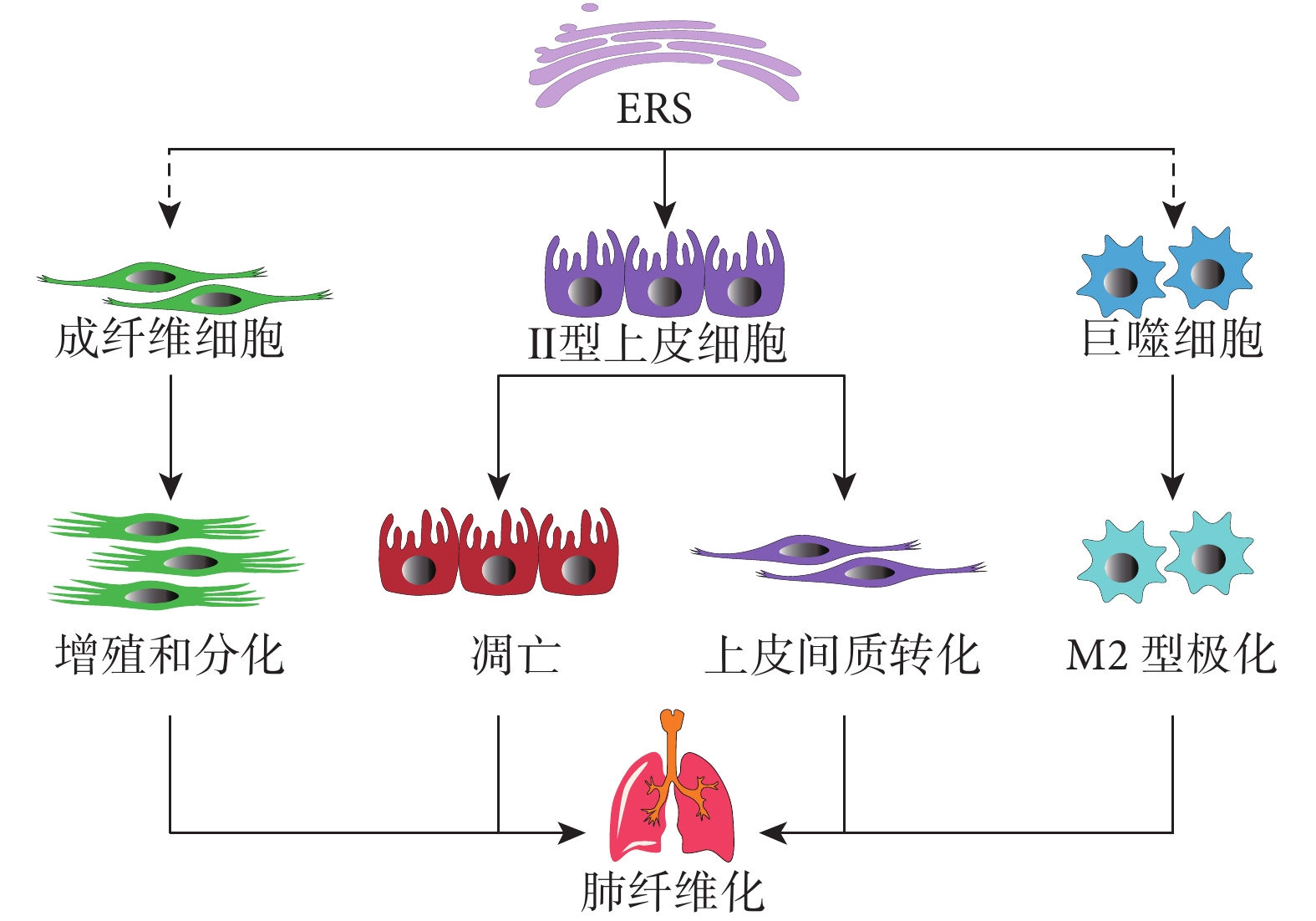
ERS 的促纖維化作用可以通過肺的幾種不同細胞類型轉導,包括 AEC、成纖維細胞和巨噬細胞(圖 3)。
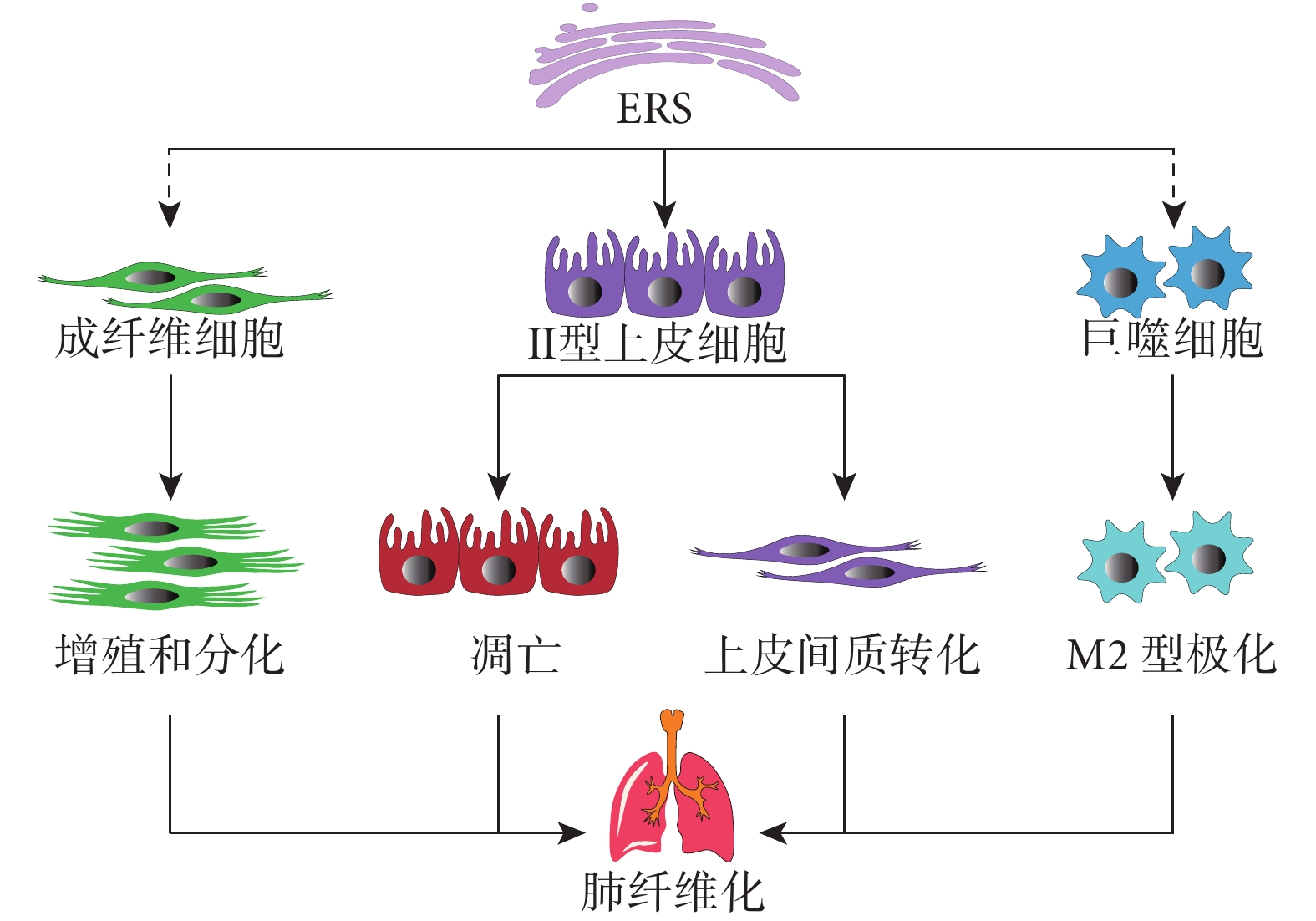 圖3
ERS 對不同細胞的促纖維化作用
圖3
ERS 對不同細胞的促纖維化作用
4.1 上皮細胞
肺泡表面被大量 AEC Ⅰ和少量 AEC Ⅱ覆蓋,前者是介導氣體交換的主要細胞類型,后者負責合成表面活性物和維持肺泡完整性。AEC Ⅱ每秒可以分泌上萬個蛋白,肺部近 50% 的線粒體都分布于 AEC Ⅱ[34]。在 IPF 患者的肺中,ERS 主要發生在 AEC Ⅱ中[12, 15]。雖然 ER 可以承受一定范圍的波動,但是 IPF 患者肺部堆積的錯誤折疊蛋白已經產生了細胞毒性[55]。研究發現 IPF 患者的 AEC 中 BiP、EDEM、XBP1、ATF4、ATF6 和 CHOP 的表達增加[12],同時伴有 cleaved Caspase-3 誘導的細胞凋亡[15]。
在 AEC Ⅱ細胞系中,SFPTC 基因突變可以導致 ERS 和細胞凋亡[12-13],SFTPC 突變小鼠則表現出胎兒致死表型,包括胎鼠肺結構破壞,表面活性蛋白加工缺陷[56]。利用 ERS 激動劑衣霉素對 SFTPC 突變小鼠進行氣管滴注誘導 ERS,或者對其 AEC Ⅱ進行體外誘導 ERS,均未發現肺纖維化加重以及細胞凋亡,但此時僅低劑量博來霉素就可以使肺纖維化顯著加重,同時 AEC Ⅱ細胞凋亡也明顯增多[55]。因此,一定程度的 ERS 水平還不足以誘導肺纖維化,但提高了肺纖維化的敏感性。
ERS 調節 AEC 凋亡的機制尚不完全清楚,但在 SFTPC 突變的 AEC Ⅱ中 Caspase-4/12 是細胞凋亡的重要介質[55],同時伴隨 cleaved Caspase-3 的活化[13]。CHOP 也是 ERS 介導 AEC 凋亡的重要途徑,有學者發現博來霉素誘導的 CHOP 缺陷小鼠 AEC 凋亡更少,纖維化程度更輕[57],但也有學者發現博來霉素誘導的 CHOP 缺陷小鼠死亡率更高,肺纖維化程度更重[58],因此通過敲除 CHOP 減少 AEC 凋亡是否行之有效尚存爭議。
ERS 誘導的 AEC 凋亡還涉及其他機制。CAMKⅡ可以通過上調 ER Ca2+以降低 CHOP 來促進 AEC 凋亡,而過表達 CaMKⅡ抑制肽 AC3-I 則可以逆轉這一過程[59]。此外,ERS 可以減少 AEC Ⅱ的 PINK1 表達,從而降低線粒體功能并 AEC 凋亡增加,同時 PINK1 缺失也可逆向誘導 ERS[34],說明 ERS、線粒體功能障礙和纖維化重塑之間相互影響且存在反饋機制。
除了 AEC 凋亡之外,ERS 誘導劑或 SFTPC 突變誘導 AEC 發生的 EMT,可能是 ERS 和纖維化之間的另一種潛在機制,表現為間充質細胞標志物 α-SMA、波形蛋白、N-cad 的表達增加,以及上皮細胞標志物 E-cad、ZO-1 的表達減少,其中 IRE1α/XBP1 通路至關重要[14]。SFTPC 突變或 ERS 誘導劑引起的 ERS 還可以促進了膠原蛋白的合成和分泌,部分依賴于 TGFβ/Smad 信號通路[60]。
4.2 成纖維細胞
間充質成纖維細胞對于血管形成、感知損傷、募集炎癥細胞以及重塑器官是必不可少的,有利于維持生理組織平衡。然而損傷、感染等引發成纖維細胞分化為活化的肌成纖維細胞,驅動病理性炎癥和 ECM 過度沉積,最終導致組織纖維化伴有進行性瘢痕形成。肌成纖維細胞分化是纖維化疾病的基本特征,活化的肌成纖維細胞產生大量膠原和 ECM[1-3]。通常認為這是由上皮細胞功能障礙和異常 EMT 傳導引起的,并受各種細胞因子,尤其是 TGF-β 的調節。但在 IPF 患者肺組織的成纖維細胞中也觀察到 BiP 的高表達,而通過 4-苯基丁酸(4-PBA)抑制 ERS 可以減少 TGF-β1 誘導的肌成纖維細胞分化、α-SMA 表達和膠原合成[61]。而沉默成纖維細胞中的鈣網蛋白則減少了 TGF-β1 誘導的膠原和纖連蛋白的產生[62]。此外,PI3K/AKT 信號通路調控的 ERS 與成纖維細胞增殖和分化相關[63]。總之,這些數據建立了一種新機制,顯示 ERS 可以促進肌成纖維細胞分化,從而促進肺纖維化的發展,但是否是 IPF 關鍵致病機制仍有待確定。
4.3 巨噬細胞
巨噬細胞幾乎存在于身體的所有組織中,并且在微生物環境的變化中對先天性和適應性免疫起著關鍵作用,肺巨噬細胞可以被分成肺泡巨噬細胞和間質巨噬細胞。主要負責產生促炎細胞因子的巨噬細胞稱為 M1 型巨噬細胞,主要負責減輕炎癥反應和增強組織修復的巨噬細胞稱為 M2 型巨噬細胞。巨噬細胞可通過分泌促纖維化因子(如 TGF-β)、趨化因子和基質金屬蛋白酶促進肺纖維化[64]。ERS 影響巨噬細胞表型取決于疾病的病理生理背景,但在 IPF 中肺巨噬細胞更多傾向于向 M2 型極化,在 IPF 肺組織纖維化灶中以 M2 型巨噬細胞浸潤為主,同時觀察到可以誘導巨噬細胞 M2 型極化的 IL-4 和 IL-13 表達也顯著升高。研究發現 IPF 患者的 M2 型巨噬細胞中 CHOP 表達增高,CHOP 在博來霉素誘導的肺纖維化模型小鼠中可以誘導肺巨噬細胞向 M2 型極化,而 CHOP 缺陷小鼠在薄來霉素誘導后 M2 型巨噬細胞浸潤大大減少且 TGF-β 分泌明顯減少[52]。除了對巨噬細胞極化的影響,ERS 還可以通過 CHOP 誘導巨噬細胞凋亡來抵消 M2 型極化對纖維化進程的影響[58],然而 ERS 和巨噬細胞之間的相互作用非常復雜,在 IPF 中究竟是具有致病性還是保護性仍須進一步探索。
5 潛在的治療方法
在很多疾病的治療中,研究者都對靶向 ERS 和 UPR 十分感興趣,然而我們還是應該謹慎對待,因為該系統本身具有適應性和穩定性,并且 PERK、ATF6、IRE1 或 XBP1 的基因敲除小鼠都出現了流產或新生小鼠死亡的現象,因此靶向 UPR 主要組分很可能產生細胞毒性而不是治療作用[6]。盡管如此,仍有研究發現,一個可以變構調節 IRE1α 寡聚體 RNA 酶活的小分子抑制劑,可以讓細胞在 ERS 下繼續存活,從而證明對上游 UPR 介質的微調可能是有益的[65]。而 UPR 下游或末端效應子對于維持體內正常生理平衡不一定產生影響,比如 CHOP 基因敲除小鼠被證明是完全可行的[66],因此,靶向 ERS 下游效應子可能是治療肺纖維化行之有效的策略之一。減少 ERS 的另一種方法可以是通過藥物增強分子伴侶功能來加速蛋白質加工。例如 4-PBA 和牛磺熊去氧膽酸(TUDCA)對纖維化模型小鼠有益[57, 67],但這些分子伴侶在 IPF 中的作用還需要進一步探索。由于 ERS 和 UPR 涉及大量細胞內因子相互作用,因此在選擇用藥靶點時一定要充分考慮這種生物學復雜性。
6 未來的研究方向
雖然目前證據表明 ERS 誘導 AEC Ⅱ凋亡是促進纖維化的決定性因素,但還需要進一步探究 ERS 其他潛在的促纖維化作用。有研究者已經在 IPF 患者上皮細胞中觀察到衰老標志物 p16 和 p21[68-69],但衰老和 ERS 在 IPF 中是否有相互作用還不明確,因此 ERS 和衰老之間的聯系是未來研究的重要領域。線粒體功能障礙也是導致 ERS 的因素之一,但在一些 IPF 患者中,ERS 可能是結果而不是原因,因此線粒體定向療法是否可以降低 IPF 患者肺部 ERS 還有待確定,也就是說,同時增強蛋白折疊功能和線粒體功能是否可以恢復 IPF 患者肺泡上皮蛋白穩態還有待進一步確認。與此同時,ERS 或線粒體功能障礙如何最終導致肺纖維化目前也尚不清楚,新的證據表明線粒體功能障礙可以觸發細胞發生分泌型衰老表型導致一些組織發生纖維化反應,這種線粒體功能障礙相關性衰老表型可以產生大量 TGF-β1[70],這將線粒體功能障礙、ERS、衰老和肺纖維化都聯系了起來,但具體的機制還需更深入的研究。此外,除了由個體細胞中的特定因子引起的 ERS 之外,UPR 的非細胞自主功能(可傳遞的 ERS)是未來研究的另一個重要領域。最近,有研究報告了 ERS 可以從一種細胞類型傳播到另一種細胞類型,包括飲食誘導的肥胖和糖尿病[71]、病毒性心肌炎[72]和癌癥[72]。最后,雖然體內外研究已經揭示了 ERS 信號通路的促纖維化作用,但進一步確定哪些途徑在 IPF 患者中發揮主要作用至關重要。隨著技術的進步,希望通過對 IPF 患者樣本分離的單細胞進行的基因組學、轉錄組學和蛋白質組學研究,來填補 UPR 不同途徑和下游促纖維化通路之間相關性知識的空白。更深層次理解不同細胞類型中 ERS 的原因和機制,將更加有利于針對改善這種疾病預后的臨床研究。
7 總結
ERS 是 IPF 及其他各種慢性纖維化疾病發生發展的重要因素之一,我們回顧了最近與肺組織中主要的促纖維化細胞相關的研究,并收集了 ERS 可能在肺纖維化的發生和發展過程中起關鍵作用的證據。IPF 患者肺組織發生 ERS 后通過 UPR 觸發 PERK、ATF6 和 IRE1 三條信號通路,從而影響不同細胞類型的功能狀態。雖然 UPR 三條信號通路激活后都可以一定程度減輕 ERS,但是嚴重或慢性的 ERS 卻可以激活 Casepase4/Caspase12、CHOP 等細胞凋亡途徑,造成細胞損傷甚至細胞死亡。其中最主要影響 AEC,與增加的 AEC 凋亡及其他促纖維化表型相關。此外,其他細胞類型(包括成纖維細胞和巨噬細胞)的 ERS 也可以導致促纖維化反應。這些研究表明,針對 ERS 設計的治療方法在 IPF 的臨床治療中可能是有效的。雖然這些發現令人興奮,但在 IPF 發病機制中 ERS 和 UPR 途徑的確切機制仍存在很多問題,導致 IPF 患者 ERS 的上游因子和介導 ERS 相關表型的效應分子需進一步明確,開發干擾 UPR 特定效應分子的安全有效藥物將為通過調節 ERS 發揮抗纖維化作用提供新策略。
利益沖突:本文不涉及任何利益沖突。
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是最常見的特發性間質性肺炎,是一種慢性、進行性、不可逆性和致死性肺部疾病,多發于中老年男性,中位發病年齡為 65 歲。其病理學主要表現為胸膜下和基底部的纖維化與蜂窩樣改變,以及肺纖維化灶周圍的膠原和細胞外基質(extracellular matrix,ECM)沉積,最終導致肺組織結構改變,肺通氣和彌散功能喪失而危及生命。雖然 IPF 發病率極低,在歐洲和北美洲每 10 萬人中僅有 2.8~18 例 IPF 患者,在亞洲和南美洲每 10 萬人中僅有 0.5~4.2 例 IPF 患者[1],但隨著人口老齡化程度日益加深,流行病學調查顯示 IPF 發病率正在逐年升高[2]。IPF 的發病機制至今仍未完全明確,歷史上曾一度認為 IPF 是慢性炎性疾病,但隨著抗炎治療宣告失敗,專家們才開始重新評估其發病機制[1]。近年來,IPF 的發病機制正逐步被揭示,但是仍缺乏有效的治療手段,診斷后的中位生存期僅為 2~4 年[1]。
目前研究主要認為,基因突變和環境暴露是 IPF 的重要致病因素,其中基因突變主要包括 SFTPC、TOLLIP、TERT、TERC、MUC5B 等,環境暴露主要包括吸煙、粉塵、病毒等[1],這些因素都可以引起肺泡上皮細胞(alveolar epithelial cell,AEC)功能障礙,引發 AEC 內質網應激(endoplasmic reticulum stress,ERS),激活轉化生長因子-β(transforming growth factor-β,TGF-β)并分泌生長因子、趨化因子等,誘發上皮間質轉化(epithelial-mesenchymal transition,EMT),招募成纖維細胞和促進成纖維細胞分化,病理性間充質細胞繼而釋放大量 ECM,最終導致肺重塑和瘢痕肺[3]。因此,AEC 是 IPF 發生的關鍵因素,肺成纖維細胞是 IPF 發展的重要環節。除此之外,炎癥細胞也參與了 IPF 的發生發展,如巨噬細胞。AEC 又分為Ⅰ型肺泡上皮細胞(alveolar epithelial cell Ⅰ,AEC Ⅰ)和Ⅱ型肺泡上皮細胞(alveolar epithelial cell Ⅱ,AEC Ⅱ),其中 AEC Ⅱ是祖細胞,可以啟動肺泡上皮修復,產生新的 AEC Ⅱ或分化為 AEC Ⅰ,對于肺發育和再生至關重要[4-5]。而導致 AEC Ⅱ功能異常的重要因素之一即為 ERS。
內質網(endoplasmic reticulum,ER)是一種負責維持蛋白質穩態的細胞器。ER 的主要功能是蛋白折疊,并在蛋白到達其目標位置前對其進行質量控制。任何擾亂蛋白加工的條件都可能導致 ER 中錯誤折疊蛋白的積累,這種情況稱為 ERS。為了應對 ERS,細胞啟動一種信號級聯反應,稱為未折疊蛋白反應(unfold protein response,UPR)。UPR 最初旨在恢復蛋白穩態,但長期或嚴重的 ERS 卻可能導致細胞死亡[6]。慢性 ERS 是諸多疾病的主要病因,包括神經退行性疾病、糖尿病、癌癥和代謝性疾病[7]。目前證據表明 ERS/UPR 在腎臟、心臟、肝臟、胃腸道和肺等器官的纖維化中發揮關鍵作用[8]。2001 年研究首次發現 ERS 和 IPF 之間有潛在聯系,發現家族性 IPF 可能是由 AEC Ⅱ中的 SFTPC 突變引起[9],當 SFTPC 突變體在肺上皮細胞系中表達時,可以導致突變蛋白在 ER 中積累,從而使細胞發生 ERS[10-14]。之后更多研究表明,ERS 不論在家族性 IPF 還是在散發性 IPF 患者的肺部都普遍存在[12, 15]。本文重點介紹 ERS 在 IPF 中作用的進展。文中出現的基因或蛋白的英文縮寫詳見表 1。
1 ERS 和 UPR
每個細胞每分鐘可以產生幾百萬個蛋白質,其中至少三分之一是由 ER 來完成折疊和加工[16-17]。ER 主要功能包括蛋白質的合成、折疊、組裝和運輸,同時也負責對缺陷蛋白進行降解[18-21]。ER 中蛋白折疊是一個取決于多種因素的復雜過程[22-26],任何因素的擾動都可能導致 ERS,激活 UPR。
UPR 包含三種 ER 跨膜蛋白,分別是 PERK、ATF6 和 IRE1α,它們作為 ERS 傳感器,能夠激活下游通路,協調反應,保護細胞[18-19]。ER 伴侶蛋白 BiP 又稱 GRP78,屬于熱休克蛋白家族,在正常細胞中可以保持和 PERK、ATF6 和 IRE1α 的結合,保持傳感器處于非活動狀態。在發生 ERS 的細胞中,BiP 與傳感器解離,激活傳感器并啟動 UPR,一方面通過減少總蛋白翻譯以降低蛋白折疊負荷,另一方面通過增加關鍵伴侶蛋白和氧化還原蛋白的表達以增強內質網折疊蛋白的能力,兩方面共同作用以恢復細胞穩態(圖 1)[27-28]。
 圖1
UPR 三條作用途徑
圖1
UPR 三條作用途徑
1.1 PERK 途徑
PERK 被激活后磷酸化 eIF2α,從而通過抑制核糖體組裝來整體抑制蛋白合成,同時還上調激活 ATF4,來誘導細胞穩態基因的表達,并激活 GADD34 和 CHOP 等促凋亡因子。另外,ATF4 亦可以誘導 ATF3 的表達,繼而通過結合組蛋白脫乙酰化酶抑制基因轉錄。
1.2 ATF6 途徑
ATF6 被釋放后轉移至高爾基體中被 site1 和 site2 蛋白酶水解為 NH2 端結構域和 ATF6p50。ATF6p50 又由細胞質轉運至細胞核,激活一系列 ER 蛋白的轉錄,如鈣網蛋白、PDI、CHOP 和 XBP1 的表達。
1.3 IRE1α 途徑
IRE1α 被激活后發生二聚磷酸化,將 XBP1 mRNA 中一段 26 bp 的內含子剪切并重組為活性形式 XBP1s,隨后作為許多應激蛋白的轉錄因子,擴大 ER 的蛋白質折疊能力,同時也通過 ERAD 等途徑促進錯誤折疊蛋白的降解及運輸,包括 EDEM。激活的 IRE1α 還可以通過 RIDD 過程降解一系列 mRNA,從而影響細胞存活和其他細胞表型。
2 影響 ERS 的因素
除了遺傳因素決定的突變蛋白的表達,ERS 還可以被其他因素誘導,主要分為外源因素和內源因素。外源因素有蛋白表達的升高(如病毒感染)、活性氧(reactive oxygen species,ROS)的產生以及氧化還原平衡的失調(如吸煙);而內源因素有生物能學的損害(如缺氧、衰老)、鈣離子的轉運(如機械牽張)以及錯誤折疊蛋白清除能力的減弱(如蛋白酶體功能障礙、自噬受損)(圖 2)。
 圖2
影響 ERS 的因素
圖2
影響 ERS 的因素
病毒感染可以引起 ERS,有研究團隊通過檢測 IPF 患者肺部的皰疹病毒抗原[29],證實在 IPF 患者[12]以及家族性 IPF 患者的無癥狀親屬[30]的 AEC 中,皰疹病毒抗原和 ERS 標志物同時表達,提示皰疹病毒誘導的 ERS 在肺纖維化中發揮一定作用。
缺氧也可以誘導 ERS,蛋白錯誤折疊主要是由于在蛋白不同區域間或相鄰蛋白間的相互作用,ER 中的很多伴侶蛋白可以降低這些相互作用,而伴侶蛋白活性依賴 ATP 水解來提供能量,這種能源依賴性導致缺氧、營養缺乏或代謝障礙的細胞中常常出現 ERS[23]。有研究報道 IPF 患者肺部缺氧相關基因組表達增加[31],IPF 患者 AEC 的單細胞測序也證明細胞缺氧的存在[32]。
衰老是另一種影響 ERS 的代表性因素,可以顯著損害 ER 功能,通過減少伴侶蛋白,增加畸形線粒體和減弱蛋白酶體降解[33-36]。有研究表明,在肺纖維化小鼠模型中,老年小鼠 AEC Ⅱ中的 ERS 標志物表達比年輕小鼠高[37],提示 ERS 和衰老之間存在一定的聯系。除了衰老的直接影響,損害的 ER 質量控制機制(如 ERAD、自噬)也可以導致 ERS[38-39]。自噬標志物 LC3-Ⅱ在纖維化區域的 AEC Ⅱ中不表達,而在非纖維化區域則高表達[39]。
3 ERS 調節的信號通路
ERS 和 UPR 信號通路與纖維化疾病相關聯,主要是通過細胞凋亡、成纖維細胞活化及分化、EMT 和炎癥反應激活及極化等機制[6, 8, 40]。
3.1 凋亡
在肺及許多其他臟器中,上皮細胞凋亡是纖維化疾病的關鍵因素[6]。長期或過度的 ERS 可通過幾種 UPR 下游機制誘導上皮細胞凋亡,其一是誘導 CHOP,其二是誘導 ER 結合 Caspase-4(小鼠中為 Caspase-12),其三是誘導 JNK[18-19, 21]。研究最廣泛也最成熟的是 CHOP,它是轉錄因子 C/EBP 家族成員,通過與增強子的相互作用,既可以作為 C/EBP 轉錄活性的抑制劑,也可以作為靶基因的激動劑[41]。CHOP 通過激活促凋亡基因和抑制抗凋亡基因(如 Bcl2)來調節細胞凋亡[42]。但同時,雖然 CHOP 主要在 PERK/ATF4 下游發揮作用,但 UPR 的三條途徑都可以參與誘導 CHOP[43]。ERS 還可以通過非 UPR 途徑引起細胞凋亡,比如在 ERS 過大時,通過 Bax 和 Bak 將鈣離子釋放到細胞質中,從而引發細胞凋亡[44]。
3.2 EMT
除了對細胞凋亡的影響,ERS 還可以影響細胞分化。如 XBP1 有助于漿細胞分化[45]。而在纖維化疾病中,ERS 可以促進成纖維細胞活化,并向肌成纖維細胞分化,產生大量膠原和 ECM。有研究顯示,成纖維細胞發生 ERS 后更易受 TGF-β 誘導分化為肌成纖維細胞[46]。而在上皮細胞中,ERS 則可誘導 EMT,雖有研究證實 EMT 不能將 AEC 轉化為肺成纖維細胞,但產生的細胞表型可直接參與纖維化重塑[11, 14, 47]。此外,環孢霉素可以通過誘導腎小管上皮細胞 ERS 發生 EMT[47]。
3.3 炎癥反應
炎癥也與纖維化有關。ERS 和 UPR 途徑被證實可以調節炎癥相關信號通路,其中包括 NF-κB 和 AP-1[48]。在炎性腸病的結腸黏膜中可以同時觀察到 ERS 和炎癥[49]。骨髓源性巨噬細胞經脂多糖刺激后產生的 ERS 能夠驅動 pro-IL-1β 的合成和加工[50]。
在不同病理生理學背景下,ERS 可能使巨噬細胞極化為 M1 型(促炎型)或 M2 型(促纖維化型)[51]。在肺纖維化[52]、糖尿病[53]和過敏性氣道炎癥[54]中,ERS 可以通過 JNK 或 CHOP 依賴性機制驅使巨噬細胞向 M2 型極化。
4 ERS 對不同細胞的促纖維化作用
ERS 的促纖維化作用可以通過肺的幾種不同細胞類型轉導,包括 AEC、成纖維細胞和巨噬細胞(圖 3)。
 圖3
ERS 對不同細胞的促纖維化作用
圖3
ERS 對不同細胞的促纖維化作用
4.1 上皮細胞
肺泡表面被大量 AEC Ⅰ和少量 AEC Ⅱ覆蓋,前者是介導氣體交換的主要細胞類型,后者負責合成表面活性物和維持肺泡完整性。AEC Ⅱ每秒可以分泌上萬個蛋白,肺部近 50% 的線粒體都分布于 AEC Ⅱ[34]。在 IPF 患者的肺中,ERS 主要發生在 AEC Ⅱ中[12, 15]。雖然 ER 可以承受一定范圍的波動,但是 IPF 患者肺部堆積的錯誤折疊蛋白已經產生了細胞毒性[55]。研究發現 IPF 患者的 AEC 中 BiP、EDEM、XBP1、ATF4、ATF6 和 CHOP 的表達增加[12],同時伴有 cleaved Caspase-3 誘導的細胞凋亡[15]。
在 AEC Ⅱ細胞系中,SFPTC 基因突變可以導致 ERS 和細胞凋亡[12-13],SFTPC 突變小鼠則表現出胎兒致死表型,包括胎鼠肺結構破壞,表面活性蛋白加工缺陷[56]。利用 ERS 激動劑衣霉素對 SFTPC 突變小鼠進行氣管滴注誘導 ERS,或者對其 AEC Ⅱ進行體外誘導 ERS,均未發現肺纖維化加重以及細胞凋亡,但此時僅低劑量博來霉素就可以使肺纖維化顯著加重,同時 AEC Ⅱ細胞凋亡也明顯增多[55]。因此,一定程度的 ERS 水平還不足以誘導肺纖維化,但提高了肺纖維化的敏感性。
ERS 調節 AEC 凋亡的機制尚不完全清楚,但在 SFTPC 突變的 AEC Ⅱ中 Caspase-4/12 是細胞凋亡的重要介質[55],同時伴隨 cleaved Caspase-3 的活化[13]。CHOP 也是 ERS 介導 AEC 凋亡的重要途徑,有學者發現博來霉素誘導的 CHOP 缺陷小鼠 AEC 凋亡更少,纖維化程度更輕[57],但也有學者發現博來霉素誘導的 CHOP 缺陷小鼠死亡率更高,肺纖維化程度更重[58],因此通過敲除 CHOP 減少 AEC 凋亡是否行之有效尚存爭議。
ERS 誘導的 AEC 凋亡還涉及其他機制。CAMKⅡ可以通過上調 ER Ca2+以降低 CHOP 來促進 AEC 凋亡,而過表達 CaMKⅡ抑制肽 AC3-I 則可以逆轉這一過程[59]。此外,ERS 可以減少 AEC Ⅱ的 PINK1 表達,從而降低線粒體功能并 AEC 凋亡增加,同時 PINK1 缺失也可逆向誘導 ERS[34],說明 ERS、線粒體功能障礙和纖維化重塑之間相互影響且存在反饋機制。
除了 AEC 凋亡之外,ERS 誘導劑或 SFTPC 突變誘導 AEC 發生的 EMT,可能是 ERS 和纖維化之間的另一種潛在機制,表現為間充質細胞標志物 α-SMA、波形蛋白、N-cad 的表達增加,以及上皮細胞標志物 E-cad、ZO-1 的表達減少,其中 IRE1α/XBP1 通路至關重要[14]。SFTPC 突變或 ERS 誘導劑引起的 ERS 還可以促進了膠原蛋白的合成和分泌,部分依賴于 TGFβ/Smad 信號通路[60]。
4.2 成纖維細胞
間充質成纖維細胞對于血管形成、感知損傷、募集炎癥細胞以及重塑器官是必不可少的,有利于維持生理組織平衡。然而損傷、感染等引發成纖維細胞分化為活化的肌成纖維細胞,驅動病理性炎癥和 ECM 過度沉積,最終導致組織纖維化伴有進行性瘢痕形成。肌成纖維細胞分化是纖維化疾病的基本特征,活化的肌成纖維細胞產生大量膠原和 ECM[1-3]。通常認為這是由上皮細胞功能障礙和異常 EMT 傳導引起的,并受各種細胞因子,尤其是 TGF-β 的調節。但在 IPF 患者肺組織的成纖維細胞中也觀察到 BiP 的高表達,而通過 4-苯基丁酸(4-PBA)抑制 ERS 可以減少 TGF-β1 誘導的肌成纖維細胞分化、α-SMA 表達和膠原合成[61]。而沉默成纖維細胞中的鈣網蛋白則減少了 TGF-β1 誘導的膠原和纖連蛋白的產生[62]。此外,PI3K/AKT 信號通路調控的 ERS 與成纖維細胞增殖和分化相關[63]。總之,這些數據建立了一種新機制,顯示 ERS 可以促進肌成纖維細胞分化,從而促進肺纖維化的發展,但是否是 IPF 關鍵致病機制仍有待確定。
4.3 巨噬細胞
巨噬細胞幾乎存在于身體的所有組織中,并且在微生物環境的變化中對先天性和適應性免疫起著關鍵作用,肺巨噬細胞可以被分成肺泡巨噬細胞和間質巨噬細胞。主要負責產生促炎細胞因子的巨噬細胞稱為 M1 型巨噬細胞,主要負責減輕炎癥反應和增強組織修復的巨噬細胞稱為 M2 型巨噬細胞。巨噬細胞可通過分泌促纖維化因子(如 TGF-β)、趨化因子和基質金屬蛋白酶促進肺纖維化[64]。ERS 影響巨噬細胞表型取決于疾病的病理生理背景,但在 IPF 中肺巨噬細胞更多傾向于向 M2 型極化,在 IPF 肺組織纖維化灶中以 M2 型巨噬細胞浸潤為主,同時觀察到可以誘導巨噬細胞 M2 型極化的 IL-4 和 IL-13 表達也顯著升高。研究發現 IPF 患者的 M2 型巨噬細胞中 CHOP 表達增高,CHOP 在博來霉素誘導的肺纖維化模型小鼠中可以誘導肺巨噬細胞向 M2 型極化,而 CHOP 缺陷小鼠在薄來霉素誘導后 M2 型巨噬細胞浸潤大大減少且 TGF-β 分泌明顯減少[52]。除了對巨噬細胞極化的影響,ERS 還可以通過 CHOP 誘導巨噬細胞凋亡來抵消 M2 型極化對纖維化進程的影響[58],然而 ERS 和巨噬細胞之間的相互作用非常復雜,在 IPF 中究竟是具有致病性還是保護性仍須進一步探索。
5 潛在的治療方法
在很多疾病的治療中,研究者都對靶向 ERS 和 UPR 十分感興趣,然而我們還是應該謹慎對待,因為該系統本身具有適應性和穩定性,并且 PERK、ATF6、IRE1 或 XBP1 的基因敲除小鼠都出現了流產或新生小鼠死亡的現象,因此靶向 UPR 主要組分很可能產生細胞毒性而不是治療作用[6]。盡管如此,仍有研究發現,一個可以變構調節 IRE1α 寡聚體 RNA 酶活的小分子抑制劑,可以讓細胞在 ERS 下繼續存活,從而證明對上游 UPR 介質的微調可能是有益的[65]。而 UPR 下游或末端效應子對于維持體內正常生理平衡不一定產生影響,比如 CHOP 基因敲除小鼠被證明是完全可行的[66],因此,靶向 ERS 下游效應子可能是治療肺纖維化行之有效的策略之一。減少 ERS 的另一種方法可以是通過藥物增強分子伴侶功能來加速蛋白質加工。例如 4-PBA 和牛磺熊去氧膽酸(TUDCA)對纖維化模型小鼠有益[57, 67],但這些分子伴侶在 IPF 中的作用還需要進一步探索。由于 ERS 和 UPR 涉及大量細胞內因子相互作用,因此在選擇用藥靶點時一定要充分考慮這種生物學復雜性。
6 未來的研究方向
雖然目前證據表明 ERS 誘導 AEC Ⅱ凋亡是促進纖維化的決定性因素,但還需要進一步探究 ERS 其他潛在的促纖維化作用。有研究者已經在 IPF 患者上皮細胞中觀察到衰老標志物 p16 和 p21[68-69],但衰老和 ERS 在 IPF 中是否有相互作用還不明確,因此 ERS 和衰老之間的聯系是未來研究的重要領域。線粒體功能障礙也是導致 ERS 的因素之一,但在一些 IPF 患者中,ERS 可能是結果而不是原因,因此線粒體定向療法是否可以降低 IPF 患者肺部 ERS 還有待確定,也就是說,同時增強蛋白折疊功能和線粒體功能是否可以恢復 IPF 患者肺泡上皮蛋白穩態還有待進一步確認。與此同時,ERS 或線粒體功能障礙如何最終導致肺纖維化目前也尚不清楚,新的證據表明線粒體功能障礙可以觸發細胞發生分泌型衰老表型導致一些組織發生纖維化反應,這種線粒體功能障礙相關性衰老表型可以產生大量 TGF-β1[70],這將線粒體功能障礙、ERS、衰老和肺纖維化都聯系了起來,但具體的機制還需更深入的研究。此外,除了由個體細胞中的特定因子引起的 ERS 之外,UPR 的非細胞自主功能(可傳遞的 ERS)是未來研究的另一個重要領域。最近,有研究報告了 ERS 可以從一種細胞類型傳播到另一種細胞類型,包括飲食誘導的肥胖和糖尿病[71]、病毒性心肌炎[72]和癌癥[72]。最后,雖然體內外研究已經揭示了 ERS 信號通路的促纖維化作用,但進一步確定哪些途徑在 IPF 患者中發揮主要作用至關重要。隨著技術的進步,希望通過對 IPF 患者樣本分離的單細胞進行的基因組學、轉錄組學和蛋白質組學研究,來填補 UPR 不同途徑和下游促纖維化通路之間相關性知識的空白。更深層次理解不同細胞類型中 ERS 的原因和機制,將更加有利于針對改善這種疾病預后的臨床研究。
7 總結
ERS 是 IPF 及其他各種慢性纖維化疾病發生發展的重要因素之一,我們回顧了最近與肺組織中主要的促纖維化細胞相關的研究,并收集了 ERS 可能在肺纖維化的發生和發展過程中起關鍵作用的證據。IPF 患者肺組織發生 ERS 后通過 UPR 觸發 PERK、ATF6 和 IRE1 三條信號通路,從而影響不同細胞類型的功能狀態。雖然 UPR 三條信號通路激活后都可以一定程度減輕 ERS,但是嚴重或慢性的 ERS 卻可以激活 Casepase4/Caspase12、CHOP 等細胞凋亡途徑,造成細胞損傷甚至細胞死亡。其中最主要影響 AEC,與增加的 AEC 凋亡及其他促纖維化表型相關。此外,其他細胞類型(包括成纖維細胞和巨噬細胞)的 ERS 也可以導致促纖維化反應。這些研究表明,針對 ERS 設計的治療方法在 IPF 的臨床治療中可能是有效的。雖然這些發現令人興奮,但在 IPF 發病機制中 ERS 和 UPR 途徑的確切機制仍存在很多問題,導致 IPF 患者 ERS 的上游因子和介導 ERS 相關表型的效應分子需進一步明確,開發干擾 UPR 特定效應分子的安全有效藥物將為通過調節 ERS 發揮抗纖維化作用提供新策略。
利益沖突:本文不涉及任何利益沖突。