主動脈弓中斷(interruption of aortic arch,IAA)合并室間隔缺損(ventricular septal defect,VSD)為復雜先天性心臟病,手術難度大,死亡率高[1-2]。早期行一期根治術是目前大多數心臟中心的首選外科治療方案[3-4],特別是在新生兒期手術,可減少側支血管和狹窄后擴張的形成[5]。多個心臟中心報道此類疾病手術死亡率較高,但其相關危險因素各中心卻報道不一。本研究通過回顧性分析我院收治并行一期根治的IAA合并VSD患兒的預后,以明確此類患兒術后死亡的危險因素。
1 資料與方法
1.1 臨床資料和分組
1.2 手術方法
全組患兒均在胸骨正中切口下行一期根治術。麻醉過程中于右側橈動脈及股動脈穿刺行持續動脈血壓監測,并行鼻咽溫及肛溫監測。充分游離升主動脈、主動脈弓橫部、頭臂干動脈、左頸總動脈、左鎖骨下動脈及降主動脈,游離過程中避免損傷喉返神經。于升主動脈插管,肺動脈側通過動脈導管插入降主動脈,兩主動脈插管采用Y型接頭相連接,同時上下腔靜脈插管建立體外循環,開始降溫。待肛溫降至18~20℃時阻斷主動脈,并于主動脈根部灌注心肌保護液;心臟停跳后將升主動脈插管插入頭臂干動脈行選擇性腦灌注,拔出降主動脈灌注管并取阻斷鉗夾閉;切斷動脈導管組織,連續縫合肺動脈端;充分游離降主動脈并徹底剪除動脈導管組織,在降主動脈完全松弛的狀態下上提降主動脈,避免形成哥特式弓[6]。最大程度避免因主動脈弓降部壓迫而導致的一側主支氣管狹窄。若降主動脈近心端與主動脈弓部遠心端距離較近,直接吻合無明顯張力,且吻合口寬大,則可行降主動脈近心端與主動脈弓遠心端的端端吻合;或切開降主動脈近心端左上方約1~1.5 cm,在弓橫部遠心端小彎側縱形切開主動脈1.5~2 cm,降主動脈近心端與弓部遠心端行擴大的直接端側吻合。若降主動脈近心端與主動脈弓部遠心端距離較遠,直接吻合存在明顯張力,則可行主動脈弓下緣后壁與降主動脈后壁直接吻合,然后取自體心包加寬吻合前壁。對于合并迷走鎖骨下動脈及Kommerell憩室的患兒行憩室切除術及鎖骨下動脈及頸總動脈移植術[7]。主動脈弓離斷矯治完成后恢復正常體外循環,在復溫過程中行心內畸形矯治,如行房間隔缺損修補術、VSD修補術、二尖瓣成形術,右心室雙出口矯治術,主肺動脈窗修補術等。存在左室流出道梗阻患兒,可通過主動脈路徑,即斜行切開主動脈根部至無冠竇,拉開主動脈瓣后充分暴露左室流出道肥厚肌束,并給予剪除,行左室流出道疏通術。在剪除左室流出道肥厚肌肉過程中避免損傷二尖瓣及腱索,同時避免剪透室間隔,造成室間隔穿孔;若通過主動脈瓣環處理左室流出道肥厚肌肉效果不理想或暴露不充分,可切開房間隔通過二尖瓣入路剪除部分肌束。在牽拉二尖瓣暴露過程中避免損傷二尖瓣,必要時行二尖瓣成形術。若VSD位于干下,可通過肺動脈瓣路徑剪除主動脈瓣下組織,疏通左室流出道后再用大塊牛心包補片將VSD與肺動脈瓣口一起補向左心。
術后常規給予多巴胺、多巴酚丁胺、米力農、腎上腺素等血管活性藥物強心治療,并給予呼吸機輔助呼吸。同時密切監測患兒血氣及尿量變化,必要時給予腹膜透析或血液透析。
1.3 資料收集
收集患者以下資料:年齡、性別、體重、疾病分型、VSD內徑與主動脈根部內徑比值(ratio of VSD diameter/aortic root diameter,VSD/AO)、體外循環時間、腦灌注時間、住ICU時間、吻合口直接吻合情況、術后早期死亡、是否伴左室流出道梗阻以及其他心臟畸形種類。
1.4 統計學分析
采用SPSS 22.0統計軟件進行統計學分析。計量資料滿足正態分布采用均數±標準差( ±s)描述,組間比較采用t檢驗;不滿足正態分布采用中位數(四分位間距)描述,組間比較采用非參數檢驗。分類變量用頻數(百分比)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用Kaplan-Meier法分析術后總體生存率,采用Cox比例風險模型分析用于識別與時間相關的術后死亡風險。P≤0.05為差異有統計學意義。
±s)描述,組間比較采用t檢驗;不滿足正態分布采用中位數(四分位間距)描述,組間比較采用非參數檢驗。分類變量用頻數(百分比)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用Kaplan-Meier法分析術后總體生存率,采用Cox比例風險模型分析用于識別與時間相關的術后死亡風險。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究經河北醫科大學第一醫院倫理委員會制定的倫理學標準并獲得批準(批準號20220721),受試對象取得了監護人的同意并簽訂了知情同意書。
2 結果
最終152例患兒納入本研究,其中男70例,女82例。按解剖分型,A型95例,B型57例。術后22例患兒死亡,130例患兒存活。全部病例均合并動脈導管未閉,其中20例合并左室流出道梗阻,3例合并Ⅰ型主肺動脈窗,2例合并右室雙出口,3例合并主動脈瓣狹窄,3例合并中重度二尖瓣關閉不全,30例合并二孔型房間隔缺損,4例合并二葉式主動脈瓣。患者術前資料見表1。
 ]
]
全組患兒行一期根治術術后因心肌水腫、血流動力學不穩定,58例患兒給予延遲關胸。術后13例患兒行開胸探查止血,15例患兒因血壓低、中心靜脈壓高,生命體征不平穩,給予床旁再開胸;16例患兒因少尿或無尿,給予藥物利尿,效果不理想后行床旁腹膜透析治療。22例患兒術后早期死亡:A型、B型患兒各死亡11例。其中3例死于低心排血量;3例死于肺高壓危象;2例死于重癥肺炎;2例死于術后大出血;2例死于重癥肺炎合并多臟器功能衰竭;2例死于心力衰竭(心衰)合并腎功能衰竭;2例死于急性左心衰合并呼吸衰竭; 2例因主動脈弓壓迫左支氣管致撤機困難,并發肺部嚴重感染致死;1例死于惡性心律失常;1例死于心衰合并腎功能衰竭;2例患兒因心肺功能差,無法脫離體外循環機,給予體外膜肺氧合支持治療后心率血壓仍無法維持,死于多臟器功能衰竭。
采用Cox比例風險回歸模型將疾病分型、年齡、體重、VSD/AO、體外循環時間、住ICU時間、腦灌注時間、是否直接吻合、是否合并左室流出道梗阻納入分析。最終,低齡(P=0.004)、低體重(P=0.003)、VSD/AO大(P=0.044)、體外循環時間長(P=0.038)、合并左室流出道梗阻(P=0.015)為術后死亡的獨立危險因素;見表2。
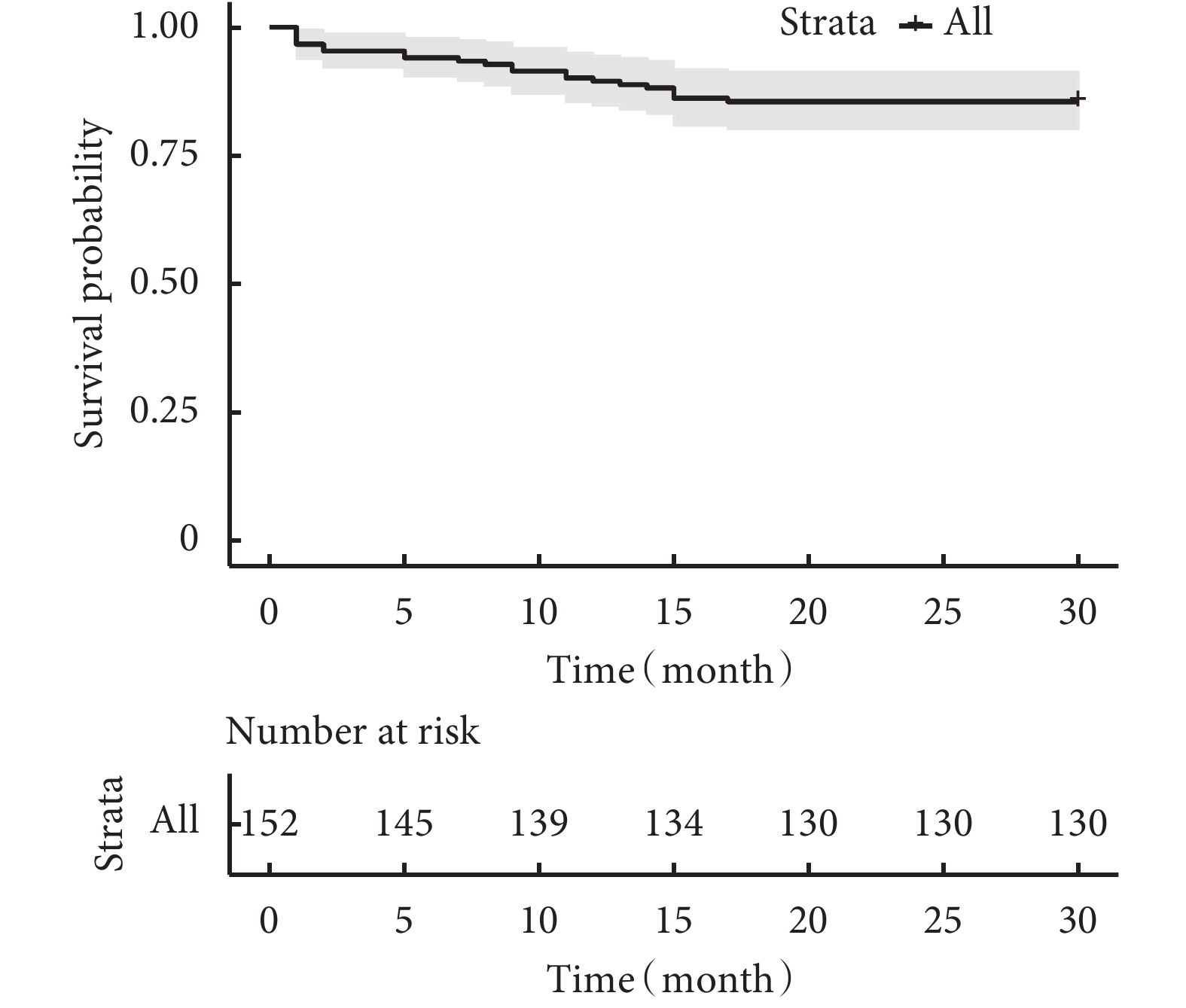
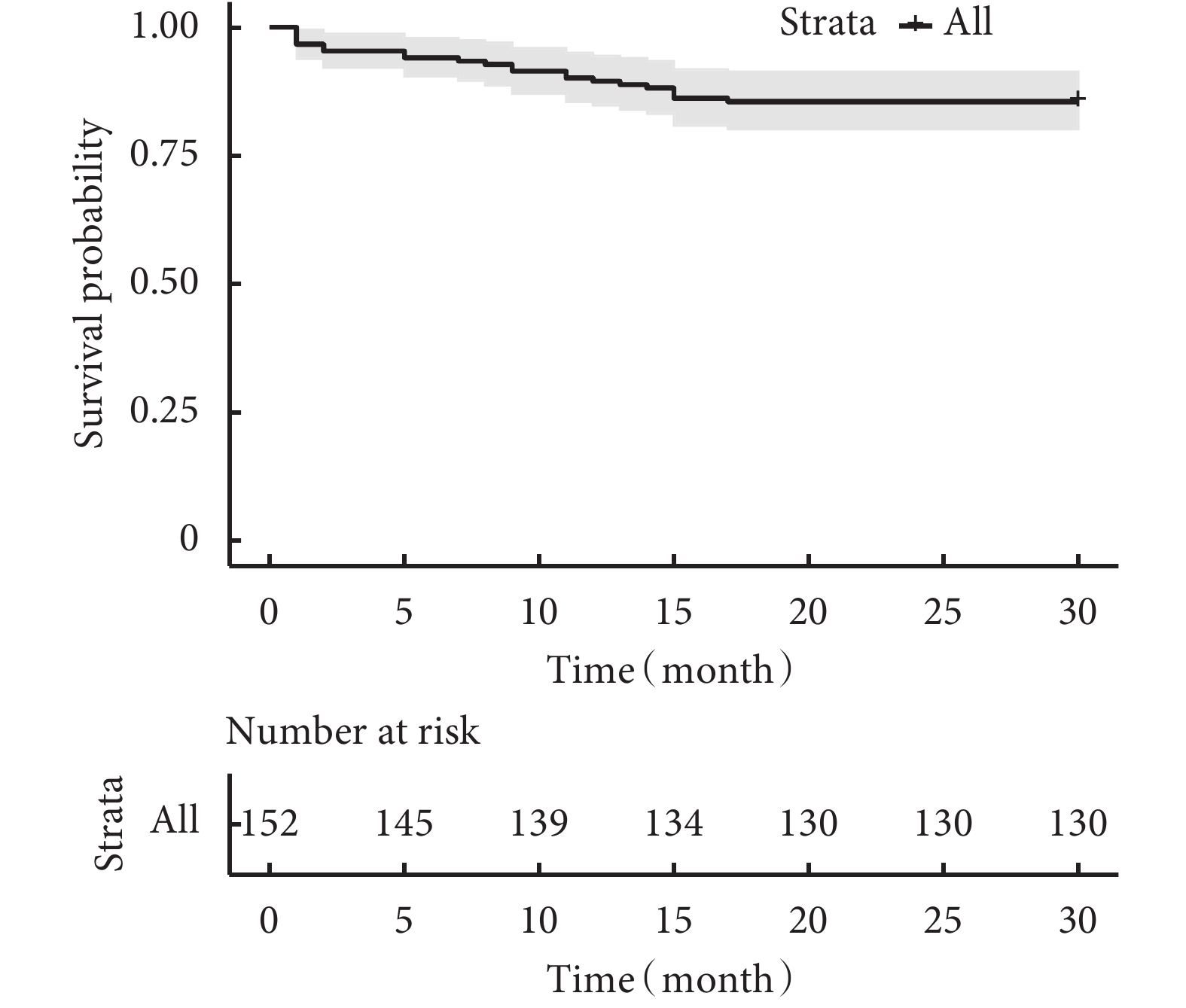 圖1
患兒總體生存率曲線
圖1
患兒總體生存率曲線
3 討論
IAA合并VSD臨床上較少見,約占所有先天性心臟病的1%~1.5%[8],常規篩查容易漏診[9]。此類疾病病情危重,自然預后差,有報道稱若未進行手術矯治,新生兒期病死率高達90%[10]。
本研究Cox比例風險回歸模型分析表明低齡、低體重是術后死亡的獨立危險因素。這與文獻[11]報道的結論相符。嬰幼兒未成熟心肌的手術耐受性差,手術時間較長,術后嚴重低心排血量綜合征發生率較高[12]。此外,文獻[13-14]報道,即便無先天性心臟病,低年齡、低體重嬰幼兒的病死率也較高。此類患兒易出現支氣管肺發育不良、呼吸衰竭,易發生腸缺血和壞死性小腸結腸炎,其腎小管和髓質腎功能有限,免疫系統不成熟[15],這些因素都增加了患兒術后死亡的風險。
較長的體外循環時間亦是術后死亡的獨立危險因素,這與相關文獻[16]報道結論相符。本研究數據表明,術后死亡患兒中新生兒所占比例為68.40%,其中早產兒占17.14%;未死亡患兒中新生兒所占比例為37.72%,這可能是較長體外循環時間導致患兒術后死亡率增高的原因。由于新生兒肺組織發育不健全,尤其是早產兒,部分存在支氣管肺發育不良[17],而新生兒血液在體外循環過程中會釋放出大量的炎性因子,同時伴隨的缺血-再灌注損傷對患兒造成嚴重影響,導致術后出現肺部感染、肺不張、急性呼吸功能衰竭等嚴重并發癥[18-19]。以上這兩方面因素將導致患此類疾病的新生兒術后死亡率明顯增加。
在我們的研究中,VSD/AO也是術后死亡的獨立危險因素,其比值越大,術后死亡風險越高。死亡患兒均合并非限制性大VSD,易出現較嚴重的肺動脈高壓及左心充血性心力衰竭[20]。其次,較大的VSD造成較多的心肌缺失,導致患兒的心臟收縮功能受到嚴重影響。術中雖然進行了VSD修補,但修補VSD的補片本身不具有收縮功能,患兒心功能代償恢復需要時間,且VSD越大,恢復時間越長。另外,患兒年齡小,心肌組織發育薄弱,在修補VSD過程中易出現縫線撕脫,造成殘余分流;越大的VSD發生上述并發癥的概率相對越高。在上述死亡患兒中,存在4例>3 mm的VSD殘余分流,較大的殘余分流易造成術后血流動力學不穩定。此外,在術后死亡患兒中,有2例患兒術后床旁超聲檢查提示較大的補片凸入左室流出道,導致梗阻。這些不利因素的疊加效應會導致患兒術后死亡風險增加。
此外,Cox比例風險回歸模型分析表明左室流出道梗阻是術后死亡的獨立危險因素。由于IAA患兒常伴有圓錐室間隔后移,致主動脈下狹窄導致左室流出道梗阻[21];手術中需切除圓錐隔肌肉,但這些操作增加了對心肌的牽拉并延長體外循環時間,操作本身又對左心室的心肌產生了較嚴重的損傷。其次,我科室在手術處理左室流出道梗阻方面仍存在一定的學習曲線。由于操作空間狹窄,暴露差,手術難度極大,易對周圍瓣器、傳導系統產生損傷,并因此導致嚴重的并發癥甚至死亡。在合并左室流出道梗阻的死亡患兒中,2例患兒因乳頭肌、腱索術中受損導致術后二尖瓣中大量反流;1例患兒術后出現室間隔穿孔;2例患兒術后發生Ⅲ度房室傳導阻滯。上述因素導致左室流出道梗阻患兒術后死亡率明顯高于無左室流出道梗阻患兒。
綜上所述,對于IAA合并VSD患兒,低齡、低體重、VSD/AO大、體外循環時間長、合并左室流出道梗阻為一期根治術后死亡的獨立危險因素。本研究亦存在局限性:首先本研究為回顧性研究,對數據的選取缺乏隨機性,亦造成了數據的偏差。其次本研究為單中心研究,病例數量有限。因此,仍需前瞻性、大樣本量研究進一步驗證本研究結論。
利益沖突:無。
作者貢獻:宋海龍負責論文設計,數據收集、整理與分析,論文初稿撰寫與修改;張會軍負責論文設計、審閱、修改,質量監督。
主動脈弓中斷(interruption of aortic arch,IAA)合并室間隔缺損(ventricular septal defect,VSD)為復雜先天性心臟病,手術難度大,死亡率高[1-2]。早期行一期根治術是目前大多數心臟中心的首選外科治療方案[3-4],特別是在新生兒期手術,可減少側支血管和狹窄后擴張的形成[5]。多個心臟中心報道此類疾病手術死亡率較高,但其相關危險因素各中心卻報道不一。本研究通過回顧性分析我院收治并行一期根治的IAA合并VSD患兒的預后,以明確此類患兒術后死亡的危險因素。
1 資料與方法
1.1 臨床資料和分組
1.2 手術方法
全組患兒均在胸骨正中切口下行一期根治術。麻醉過程中于右側橈動脈及股動脈穿刺行持續動脈血壓監測,并行鼻咽溫及肛溫監測。充分游離升主動脈、主動脈弓橫部、頭臂干動脈、左頸總動脈、左鎖骨下動脈及降主動脈,游離過程中避免損傷喉返神經。于升主動脈插管,肺動脈側通過動脈導管插入降主動脈,兩主動脈插管采用Y型接頭相連接,同時上下腔靜脈插管建立體外循環,開始降溫。待肛溫降至18~20℃時阻斷主動脈,并于主動脈根部灌注心肌保護液;心臟停跳后將升主動脈插管插入頭臂干動脈行選擇性腦灌注,拔出降主動脈灌注管并取阻斷鉗夾閉;切斷動脈導管組織,連續縫合肺動脈端;充分游離降主動脈并徹底剪除動脈導管組織,在降主動脈完全松弛的狀態下上提降主動脈,避免形成哥特式弓[6]。最大程度避免因主動脈弓降部壓迫而導致的一側主支氣管狹窄。若降主動脈近心端與主動脈弓部遠心端距離較近,直接吻合無明顯張力,且吻合口寬大,則可行降主動脈近心端與主動脈弓遠心端的端端吻合;或切開降主動脈近心端左上方約1~1.5 cm,在弓橫部遠心端小彎側縱形切開主動脈1.5~2 cm,降主動脈近心端與弓部遠心端行擴大的直接端側吻合。若降主動脈近心端與主動脈弓部遠心端距離較遠,直接吻合存在明顯張力,則可行主動脈弓下緣后壁與降主動脈后壁直接吻合,然后取自體心包加寬吻合前壁。對于合并迷走鎖骨下動脈及Kommerell憩室的患兒行憩室切除術及鎖骨下動脈及頸總動脈移植術[7]。主動脈弓離斷矯治完成后恢復正常體外循環,在復溫過程中行心內畸形矯治,如行房間隔缺損修補術、VSD修補術、二尖瓣成形術,右心室雙出口矯治術,主肺動脈窗修補術等。存在左室流出道梗阻患兒,可通過主動脈路徑,即斜行切開主動脈根部至無冠竇,拉開主動脈瓣后充分暴露左室流出道肥厚肌束,并給予剪除,行左室流出道疏通術。在剪除左室流出道肥厚肌肉過程中避免損傷二尖瓣及腱索,同時避免剪透室間隔,造成室間隔穿孔;若通過主動脈瓣環處理左室流出道肥厚肌肉效果不理想或暴露不充分,可切開房間隔通過二尖瓣入路剪除部分肌束。在牽拉二尖瓣暴露過程中避免損傷二尖瓣,必要時行二尖瓣成形術。若VSD位于干下,可通過肺動脈瓣路徑剪除主動脈瓣下組織,疏通左室流出道后再用大塊牛心包補片將VSD與肺動脈瓣口一起補向左心。
術后常規給予多巴胺、多巴酚丁胺、米力農、腎上腺素等血管活性藥物強心治療,并給予呼吸機輔助呼吸。同時密切監測患兒血氣及尿量變化,必要時給予腹膜透析或血液透析。
1.3 資料收集
收集患者以下資料:年齡、性別、體重、疾病分型、VSD內徑與主動脈根部內徑比值(ratio of VSD diameter/aortic root diameter,VSD/AO)、體外循環時間、腦灌注時間、住ICU時間、吻合口直接吻合情況、術后早期死亡、是否伴左室流出道梗阻以及其他心臟畸形種類。
1.4 統計學分析
采用SPSS 22.0統計軟件進行統計學分析。計量資料滿足正態分布采用均數±標準差( ±s)描述,組間比較采用t檢驗;不滿足正態分布采用中位數(四分位間距)描述,組間比較采用非參數檢驗。分類變量用頻數(百分比)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用Kaplan-Meier法分析術后總體生存率,采用Cox比例風險模型分析用于識別與時間相關的術后死亡風險。P≤0.05為差異有統計學意義。
±s)描述,組間比較采用t檢驗;不滿足正態分布采用中位數(四分位間距)描述,組間比較采用非參數檢驗。分類變量用頻數(百分比)描述,組間比較采用χ2檢驗或Fisher確切概率法。采用Kaplan-Meier法分析術后總體生存率,采用Cox比例風險模型分析用于識別與時間相關的術后死亡風險。P≤0.05為差異有統計學意義。
1.5 倫理審查
本研究經河北醫科大學第一醫院倫理委員會制定的倫理學標準并獲得批準(批準號20220721),受試對象取得了監護人的同意并簽訂了知情同意書。
2 結果
最終152例患兒納入本研究,其中男70例,女82例。按解剖分型,A型95例,B型57例。術后22例患兒死亡,130例患兒存活。全部病例均合并動脈導管未閉,其中20例合并左室流出道梗阻,3例合并Ⅰ型主肺動脈窗,2例合并右室雙出口,3例合并主動脈瓣狹窄,3例合并中重度二尖瓣關閉不全,30例合并二孔型房間隔缺損,4例合并二葉式主動脈瓣。患者術前資料見表1。
 ]
]
全組患兒行一期根治術術后因心肌水腫、血流動力學不穩定,58例患兒給予延遲關胸。術后13例患兒行開胸探查止血,15例患兒因血壓低、中心靜脈壓高,生命體征不平穩,給予床旁再開胸;16例患兒因少尿或無尿,給予藥物利尿,效果不理想后行床旁腹膜透析治療。22例患兒術后早期死亡:A型、B型患兒各死亡11例。其中3例死于低心排血量;3例死于肺高壓危象;2例死于重癥肺炎;2例死于術后大出血;2例死于重癥肺炎合并多臟器功能衰竭;2例死于心力衰竭(心衰)合并腎功能衰竭;2例死于急性左心衰合并呼吸衰竭; 2例因主動脈弓壓迫左支氣管致撤機困難,并發肺部嚴重感染致死;1例死于惡性心律失常;1例死于心衰合并腎功能衰竭;2例患兒因心肺功能差,無法脫離體外循環機,給予體外膜肺氧合支持治療后心率血壓仍無法維持,死于多臟器功能衰竭。
采用Cox比例風險回歸模型將疾病分型、年齡、體重、VSD/AO、體外循環時間、住ICU時間、腦灌注時間、是否直接吻合、是否合并左室流出道梗阻納入分析。最終,低齡(P=0.004)、低體重(P=0.003)、VSD/AO大(P=0.044)、體外循環時間長(P=0.038)、合并左室流出道梗阻(P=0.015)為術后死亡的獨立危險因素;見表2。
 圖1
患兒總體生存率曲線
圖1
患兒總體生存率曲線
3 討論
IAA合并VSD臨床上較少見,約占所有先天性心臟病的1%~1.5%[8],常規篩查容易漏診[9]。此類疾病病情危重,自然預后差,有報道稱若未進行手術矯治,新生兒期病死率高達90%[10]。
本研究Cox比例風險回歸模型分析表明低齡、低體重是術后死亡的獨立危險因素。這與文獻[11]報道的結論相符。嬰幼兒未成熟心肌的手術耐受性差,手術時間較長,術后嚴重低心排血量綜合征發生率較高[12]。此外,文獻[13-14]報道,即便無先天性心臟病,低年齡、低體重嬰幼兒的病死率也較高。此類患兒易出現支氣管肺發育不良、呼吸衰竭,易發生腸缺血和壞死性小腸結腸炎,其腎小管和髓質腎功能有限,免疫系統不成熟[15],這些因素都增加了患兒術后死亡的風險。
較長的體外循環時間亦是術后死亡的獨立危險因素,這與相關文獻[16]報道結論相符。本研究數據表明,術后死亡患兒中新生兒所占比例為68.40%,其中早產兒占17.14%;未死亡患兒中新生兒所占比例為37.72%,這可能是較長體外循環時間導致患兒術后死亡率增高的原因。由于新生兒肺組織發育不健全,尤其是早產兒,部分存在支氣管肺發育不良[17],而新生兒血液在體外循環過程中會釋放出大量的炎性因子,同時伴隨的缺血-再灌注損傷對患兒造成嚴重影響,導致術后出現肺部感染、肺不張、急性呼吸功能衰竭等嚴重并發癥[18-19]。以上這兩方面因素將導致患此類疾病的新生兒術后死亡率明顯增加。
在我們的研究中,VSD/AO也是術后死亡的獨立危險因素,其比值越大,術后死亡風險越高。死亡患兒均合并非限制性大VSD,易出現較嚴重的肺動脈高壓及左心充血性心力衰竭[20]。其次,較大的VSD造成較多的心肌缺失,導致患兒的心臟收縮功能受到嚴重影響。術中雖然進行了VSD修補,但修補VSD的補片本身不具有收縮功能,患兒心功能代償恢復需要時間,且VSD越大,恢復時間越長。另外,患兒年齡小,心肌組織發育薄弱,在修補VSD過程中易出現縫線撕脫,造成殘余分流;越大的VSD發生上述并發癥的概率相對越高。在上述死亡患兒中,存在4例>3 mm的VSD殘余分流,較大的殘余分流易造成術后血流動力學不穩定。此外,在術后死亡患兒中,有2例患兒術后床旁超聲檢查提示較大的補片凸入左室流出道,導致梗阻。這些不利因素的疊加效應會導致患兒術后死亡風險增加。
此外,Cox比例風險回歸模型分析表明左室流出道梗阻是術后死亡的獨立危險因素。由于IAA患兒常伴有圓錐室間隔后移,致主動脈下狹窄導致左室流出道梗阻[21];手術中需切除圓錐隔肌肉,但這些操作增加了對心肌的牽拉并延長體外循環時間,操作本身又對左心室的心肌產生了較嚴重的損傷。其次,我科室在手術處理左室流出道梗阻方面仍存在一定的學習曲線。由于操作空間狹窄,暴露差,手術難度極大,易對周圍瓣器、傳導系統產生損傷,并因此導致嚴重的并發癥甚至死亡。在合并左室流出道梗阻的死亡患兒中,2例患兒因乳頭肌、腱索術中受損導致術后二尖瓣中大量反流;1例患兒術后出現室間隔穿孔;2例患兒術后發生Ⅲ度房室傳導阻滯。上述因素導致左室流出道梗阻患兒術后死亡率明顯高于無左室流出道梗阻患兒。
綜上所述,對于IAA合并VSD患兒,低齡、低體重、VSD/AO大、體外循環時間長、合并左室流出道梗阻為一期根治術后死亡的獨立危險因素。本研究亦存在局限性:首先本研究為回顧性研究,對數據的選取缺乏隨機性,亦造成了數據的偏差。其次本研究為單中心研究,病例數量有限。因此,仍需前瞻性、大樣本量研究進一步驗證本研究結論。
利益沖突:無。
作者貢獻:宋海龍負責論文設計,數據收集、整理與分析,論文初稿撰寫與修改;張會軍負責論文設計、審閱、修改,質量監督。