近年來,多層螺旋計算機斷層掃描(computed tomography,CT)廣泛應用于肺癌的早期篩查[1],多發肺結節(multiple pulmonary nodules,MPNs)檢出率逐漸升高。有研究發現約半數的肺癌篩查患者存在MPNs[2]。Fleischner指南[3]中對于MPNs推薦使用最可疑的結節進行管理,但該指南無具體的外科介入診療時機。肺結節診治中國專家共識[4]建議對各個病灶進行獨立評估,并隨訪各個病灶的變化,選擇性局部切除變化明顯的病灶,若對MPNs患者分類和選擇最佳治療存在困難時,建議多學科討論(multi-disciplinary treatment,MDT)。在治療方式上,選擇外科手術作為MPNs治療方案的報道越來越多[5-6],外科治療的基本原則為主病灶優先同時兼顧次要病灶,但淋巴結清掃方式及剩余結節的處理方式目前尚無高質量證據指導。為此,本研究總結了在我科行手術治療的MPNs患者的臨床病理特征及短期隨訪資料,分析MPNs的診斷、鑒別診斷及外科治療的近期療效。
1 資料與方法
1.1 臨床資料
收集2018—2020年我院單一病區具有完整臨床資料的MPNs患者的外科治療及短期預后資料。納入隨訪的病例符合以下標準:(1)患者CT提示MPNs,若結節<1.5 cm抗炎治療2周或觀察,3個月后復查,若結節≥1.5 cm,經抗炎治療2周,1個月后復查;(2)經MDT討論后高度懷疑早期肺癌;(3)術后病理診斷為非小細胞癌。依據MPNs在CT縱隔窗上的表現類型分為磨玻璃結節、部分實性結節、實性結節及其它類型。按美國放射學院(American College of Radiology,ACR)制定的肺結節診斷分級系統[7],4A類及以上定義為高危結節,包括部分實性結節總直徑≥6 mm,具有毛刺征、分葉征、血管集束征,1年內磨玻璃結節大小翻倍,區域淋巴結腫大等。本研究的主要結局指標為MPNs患者的短期預后及其影響因素,次要結局指標為MPNs患者病灶位置分布、病理組合類型。
1.2 手術方案
根據患者全身情況、高危病灶的影像學定位和術中冰凍病理結果綜合制定手術方案。病灶位于同側者優先考慮同時切除高危病灶,所有高危病灶位于同一肺葉時,若患者心肺功能尚可,行肺葉切除術;若患者心肺功能耐受差時,行亞肺葉切除所有高危病灶。若高危病灶位于同側不同肺葉時,充分考慮高危病灶大小及位置并結合術中冰凍病理行肺葉聯合亞肺葉切除術或多亞肺葉切除術。由于中葉對肺功能影響較小,高危病灶位于右肺中葉內行雙肺葉切除。位于雙側者則根據影像學表現選擇同期切除或分期切除,患者全身情況及心肺功能可耐受同期手術時行亞肺葉+亞肺葉切除,患者心肺功能一般時則考慮分期手術。根據影像學檢查及術中冰凍病理決定系統性淋巴結清掃或淋巴結采樣,術中冰凍病理結果為非原位腺癌或微浸潤腺癌時優先考慮行系統性淋巴結清掃術。
1.3 診斷及鑒別診斷
MPNs的診斷主要通過術后病理確定,若術后病理提示多個結節均為惡性,則需鑒別肺內轉移癌與多原發肺癌。多原發肺癌的診斷參考Martini-Melamed診斷標準[8]:(1)病灶位于不同部位,互相獨立;(2)不同病灶組織學類型不同;(3)組織學類型相同時需滿足以下條件:1)病灶位于不同肺段、肺葉或雙側肺;2)不同病灶原位癌起源不同;3)共同引流淋巴結無轉移及無肺外轉移。由于原位腺癌與微浸潤腺癌極少出現轉移,術后病理含原位腺癌或微浸潤腺癌可初步考慮為多原發肺癌[9]。
1.4 隨訪
采用電話術后隨訪,隨訪日期截至2022年4月。無病生存期(disease-free survival,DFS)定義為末次手術日期至腫瘤復發、新發結節、殘余結節增大或末次影像學隨訪無疾病進展的時間。總生存期(overall survival,OS)的計算從首次手術日期開始至死亡當天或末次隨訪時間。
1.5 統計學分析
采用SPSS 26.0軟件對數據進行統計學分析。計量資料使用均數±標準差( ±s)或中位數及范圍描述。分類資料用例數及百分比描述。采用χ2檢驗進行率的比較。生存分析選擇Kaplan-Meier檢驗。檢驗水準α=0.05。
±s)或中位數及范圍描述。分類資料用例數及百分比描述。采用χ2檢驗進行率的比較。生存分析選擇Kaplan-Meier檢驗。檢驗水準α=0.05。
1.6 倫理審查
本研究已通過四川省腫瘤醫院倫理委員會批準,審批號:SCCHEC-02-2021-035。
2 結果
2.1 患者一般資料
共收集到99例MPNs患者臨床病理資料,其中2例患者術前影像學檢查考慮肺外轉移,因此本研究共納入97例患者,其中女67例(69.1%)、男30例(30.9%)。平均發病年齡(56.1±10.0)歲。患者一般資料見表1。24例患者具有惡性腫瘤家族史(24.8%)。97例患者在CT上共發現260枚病灶,包括雙發病灶62例,三發病灶22例,四發病灶4例,四發病灶以上9例;其中213枚高危病灶,純磨玻璃病灶89枚,部分實性病灶81枚,純實性病灶7枚。37枚病灶具有毛刺征,14枚病灶具有分葉征,13枚具有血管束征,213枚病灶均無圓形或類圓形征象。病灶位于同側肺者85例,其中同一肺葉49例,同側肺不同肺葉36例,病灶位于雙側肺者12例。平均主病灶大小(1.5±0.7)cm。不同性別(P=0.211)、年齡(P=0.537)、家族史(P=0.597)、吸煙史(P=0.198)及飲酒史(P=0.563)患者高危病灶是否位于同一肺葉差異無統計學意義。高危病灶的位置分布與臨床病理特征關系見表2。
 ]
]
2.2 手術結果
所有患者均接受胸腔鏡手術,其中5例為胸腔鏡輔助小切口手術。87例患者接受同期手術,其中3例行雙側同期手術,10例先行單側肺手術,平均間隔5.2(4~10)個月后行對側肺手術。手術方式包括肺葉切除術、肺段切除術及楔形切除術,亞肺葉切除術切緣距病灶≥2 cm。其中37例病灶位于同一肺葉患者接受肺葉切除術,12例病灶位于相同肺葉患者接受聯合亞肺葉切除術,13例位于同側不同肺葉患者行高危病灶肺葉切除和次要病灶亞肺葉切除,1例同期行單側肺葉+對側亞肺葉切除術,2例同期行雙側亞肺葉切除術。由于右肺中葉對肺功能的影響相對較小,本研究的5例患者接受包括右肺中葉在內的雙肺葉切除;見表3。手術切除所有高危病灶,切除全部病灶者71例,有殘余病灶者26例,共處理病灶213枚(81.9%),殘余結節47枚。41例患者完成系統性淋巴結清掃,56例患者完成淋巴結采樣,97例患者共清掃1 018枚淋巴結。首次手術后中位住院時間5(3~16)d,無圍術期死亡病例。
2.3 病理資料
97例患者術后病理至少有1個結節為惡性腫瘤,90例患者結節均為惡性腫瘤,7例患者兼有良性病灶。將213枚病灶進行病理分型,其中鱗癌2枚,良性病灶7枚,原位腺癌24枚,微浸潤腺癌52枚,浸潤性腺癌127枚,腺癌占比高達95.7%。送檢全部淋巴結均未查見轉移。手術及病理資料見表3。術后病理含原位腺癌或微浸潤腺癌50例,僅含浸潤性腺癌46例,最常見的病理組合為腺癌-腺癌(96例),鱗癌-鱗癌組合1例。參考多原發肺癌診斷標準,診斷為多原發肺癌97例,未見轉移癌。97例患者中主病灶ⅠA1期33例,ⅠA2期44例。兩種病理組合在年齡上差異具有統計學意義(χ2=9.938,P=0.002),在性別(P=0.167)、家族史(P=0.238)、吸煙史(P=0.068)及飲酒史(P=0.440)上差異無統計學意義;見表4。
2.4 隨訪結果
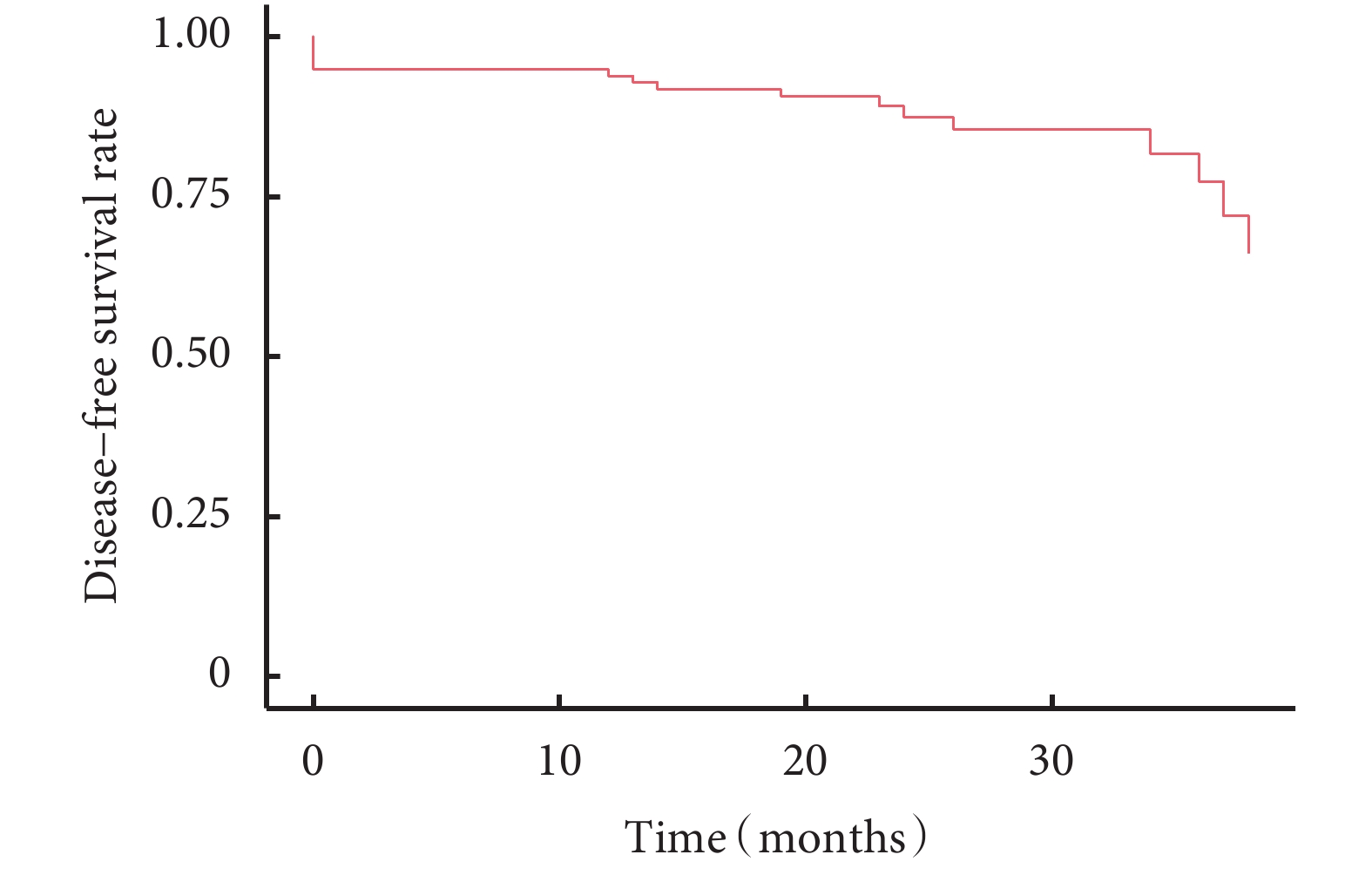
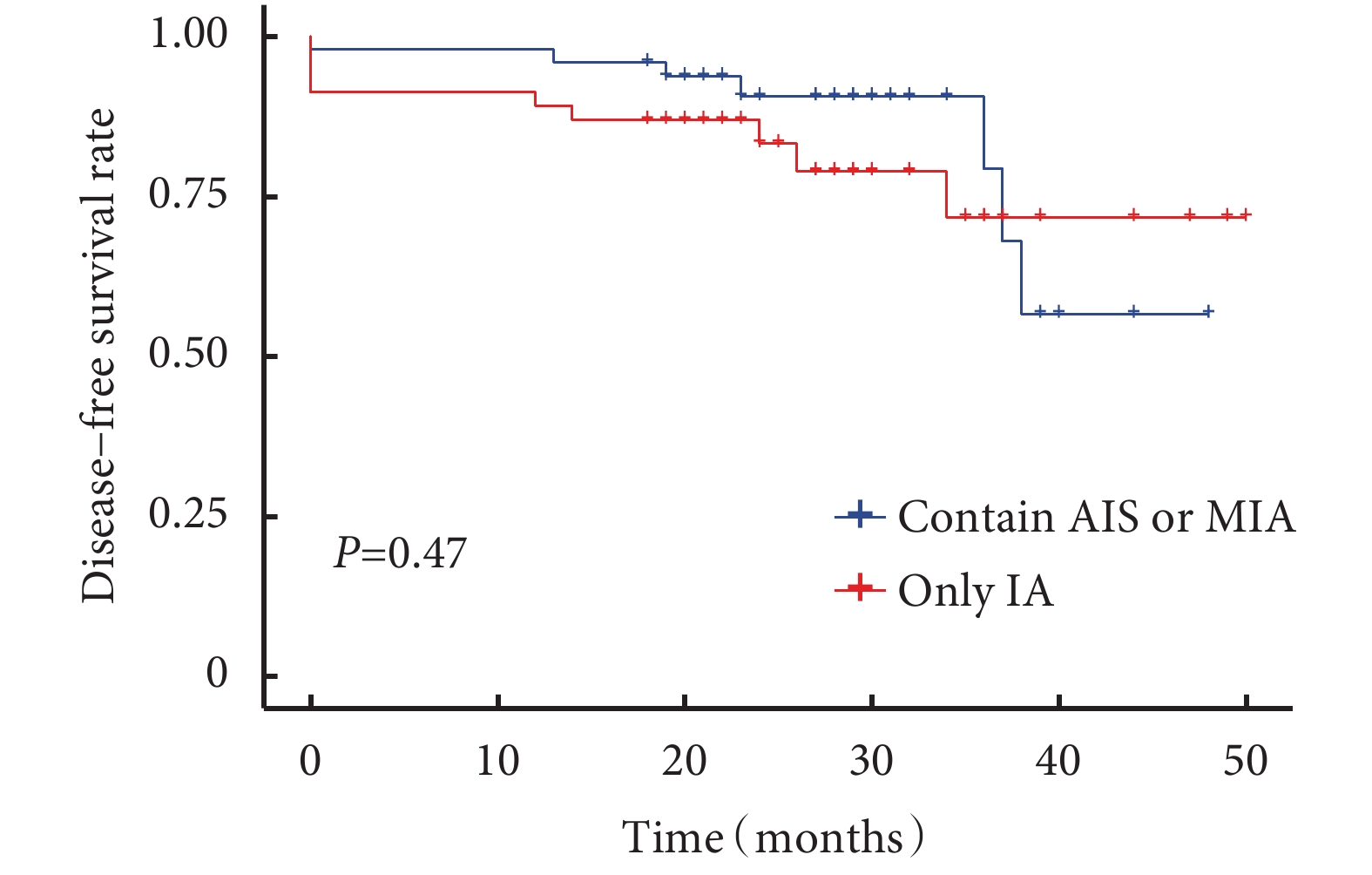
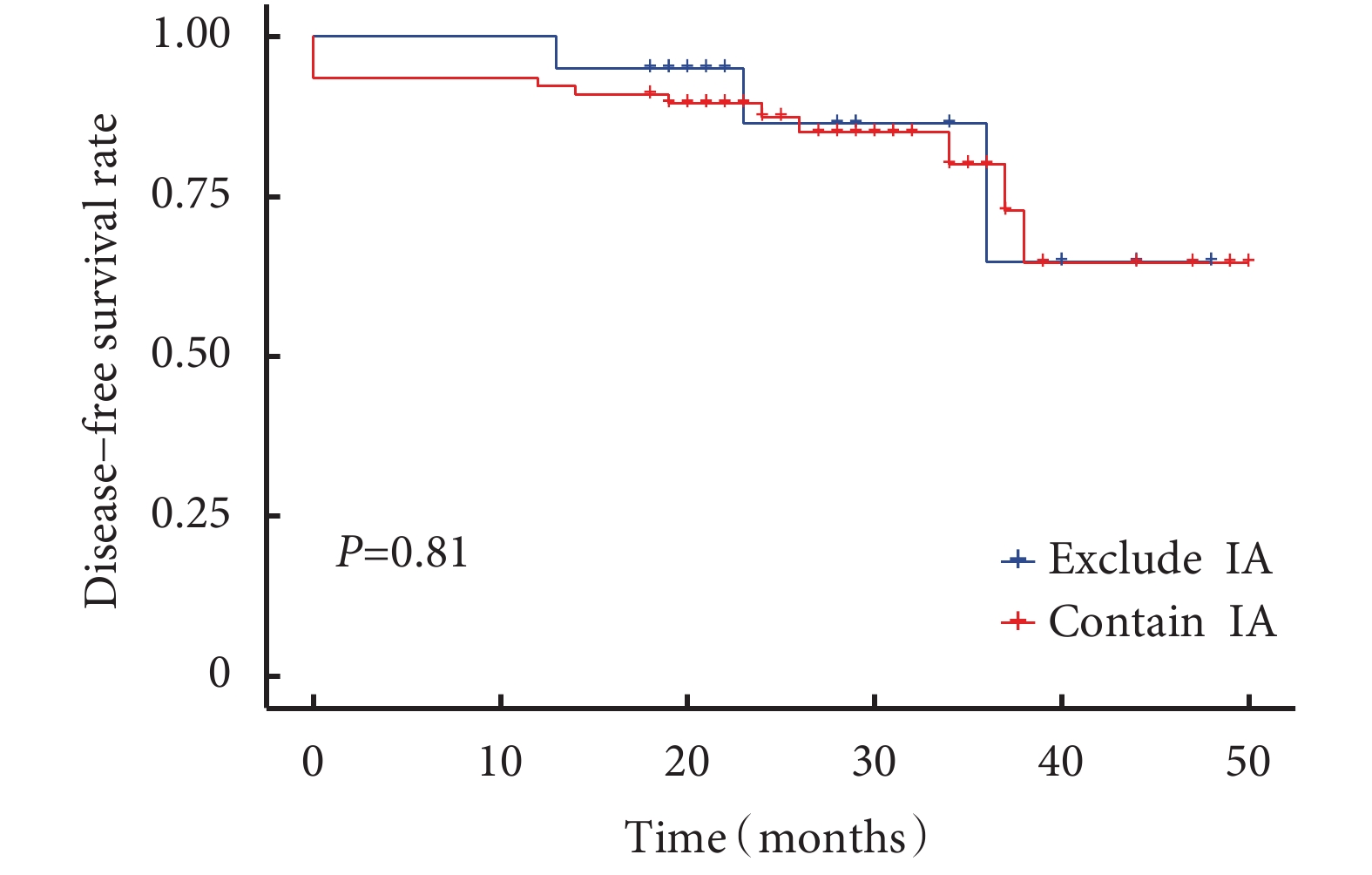
所有患者術后中位隨訪時間為24(18~50)個月,隨訪率為94.8%。隨訪過程中發現11例患者新發肺結節(新發結節定義為新出現的直徑≥3 mm肺結節,經抗炎治療后仍然存在),術后新發結節曲線見圖1。含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌的生存曲線見圖2,含浸潤性腺癌與僅含原位腺癌或微浸潤腺癌的生存曲線見圖3。術后2年、3年DFS率分別為92.1%和81.2%,術后2年、3年OS率均為100.0%。6例患者隨訪過程中胸部CT發現新發結節,4例患者在隨訪過程中出現結節增長,平均增長4 mm。不同性別、年齡、家族史、吸煙飲酒史、高危病灶最大徑、高危病灶是否位于同側、高危病灶是否位于相同肺葉、病理組合類型、殘余病灶、高危結節數量及手術方式患者的DFS率差異無統計學意義;見表5。
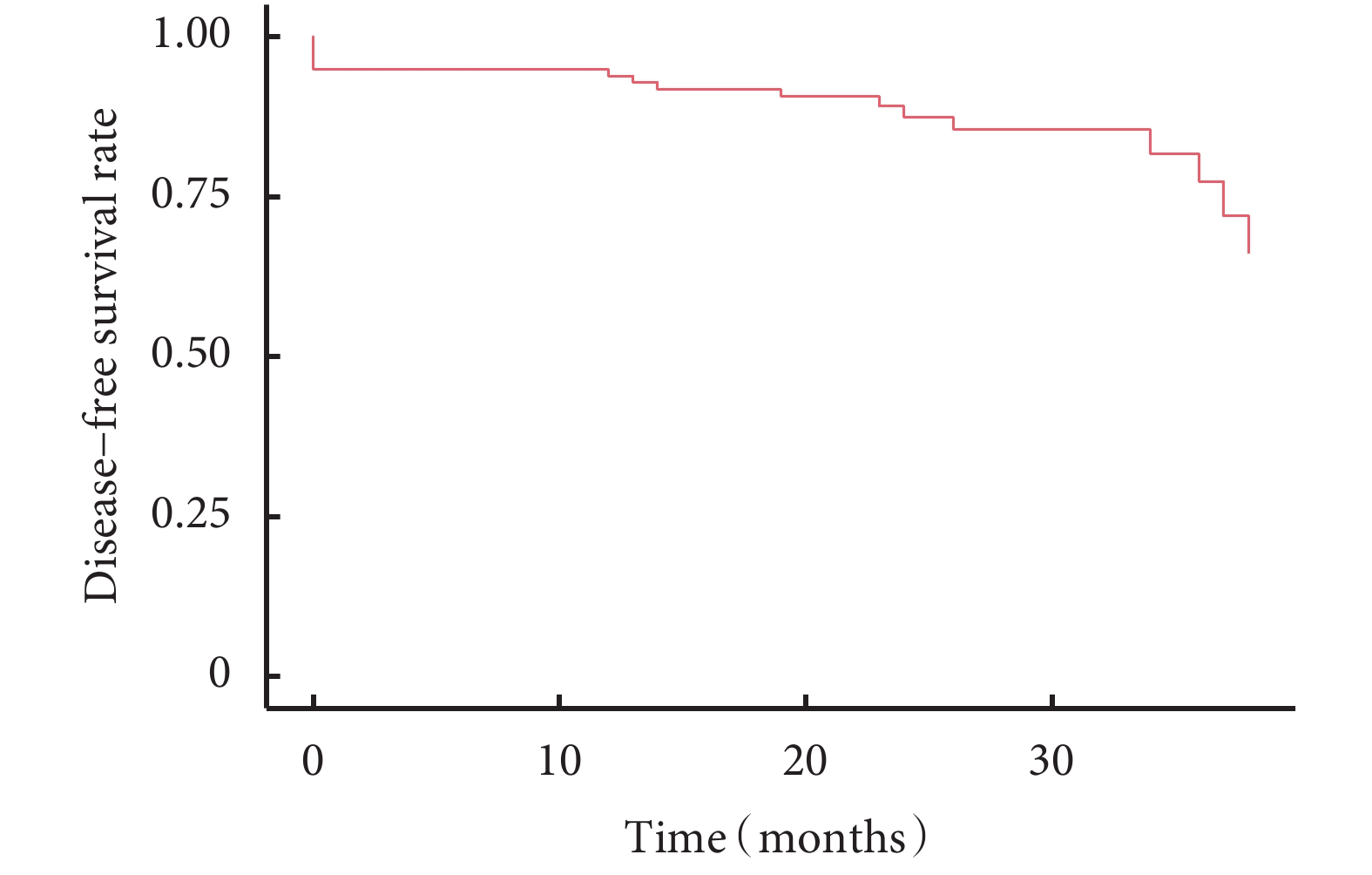 圖1
97例多發肺結節患者無病生存曲線
圖1
97例多發肺結節患者無病生存曲線
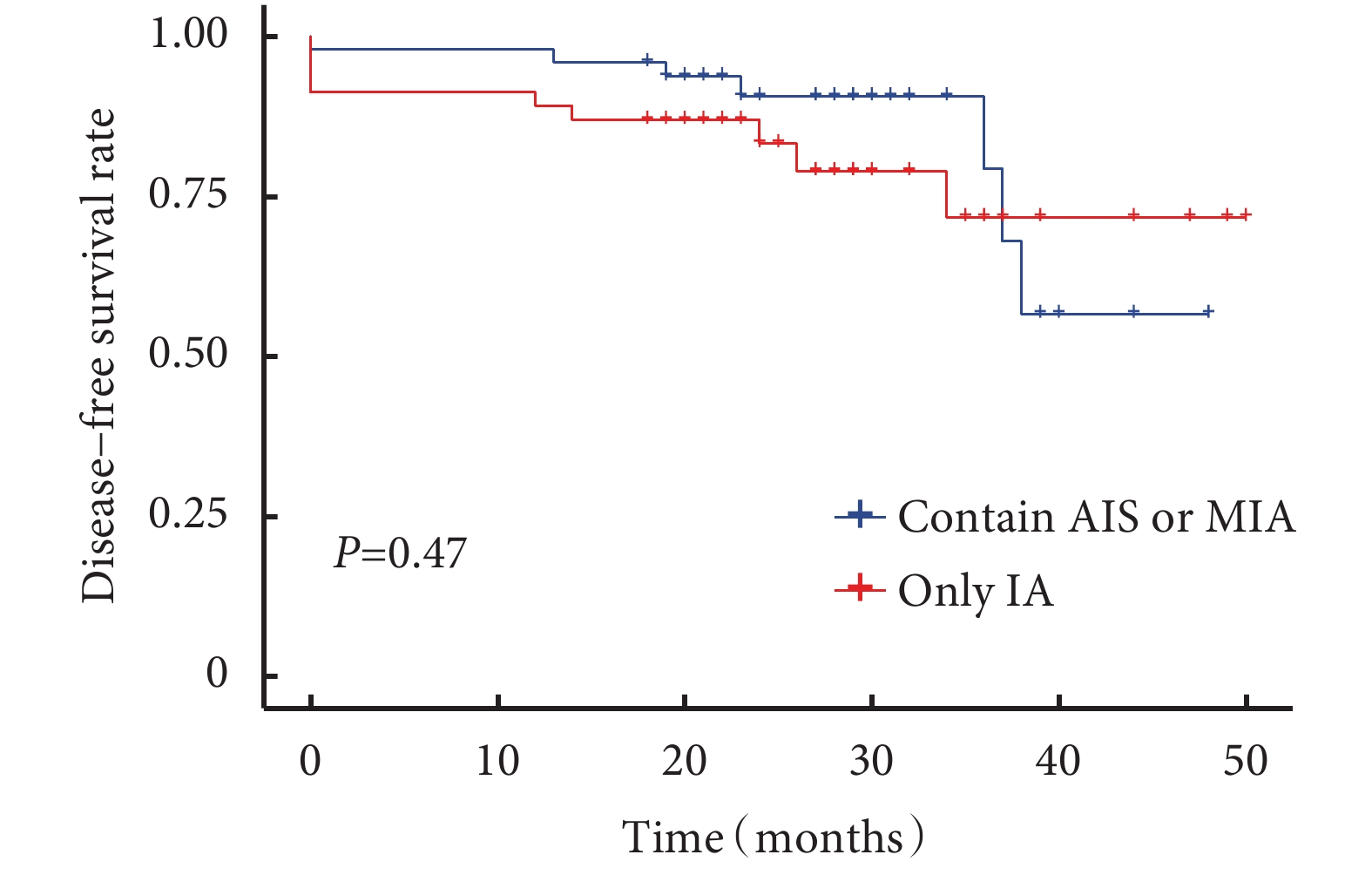 圖2
含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌患者生存曲線
圖2
含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌患者生存曲線
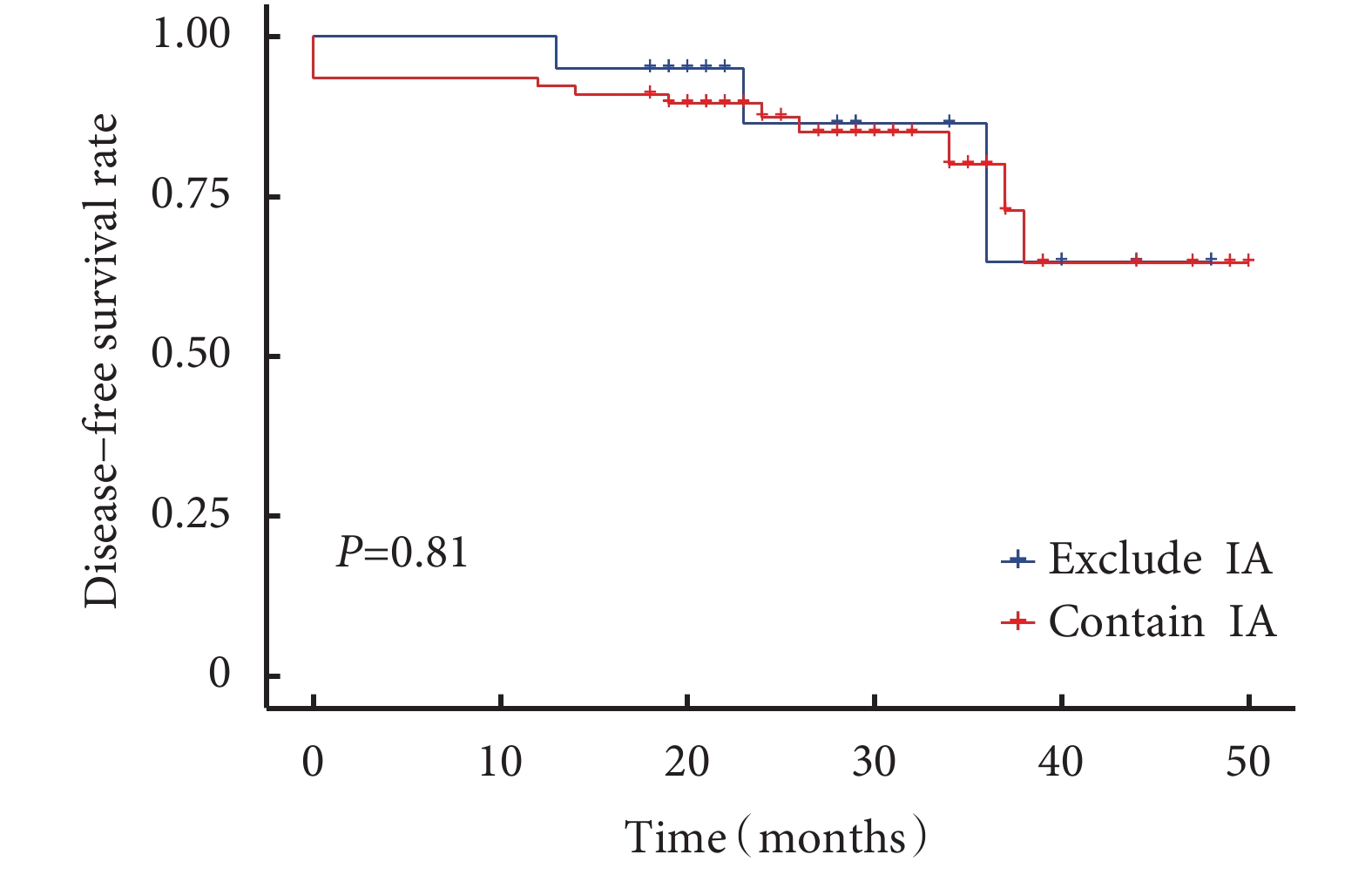 圖3
含浸潤性腺癌與不浸潤腺癌患者生存曲線
圖3
含浸潤性腺癌與不浸潤腺癌患者生存曲線
3 討論
近年來,如何做好MPNs患者的全程管理成為臨床醫師研究的重點之一。MPNs手術時機的選擇,多個指南不盡相同,但都提出應先篩選出高危結節后再行手術治療。2020年美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)肺癌篩查指南[10]指出:對于單發磨玻璃結節,隨訪中大小性質穩定,即使結節>2 cm也可持續觀察,就部分實性結節而言,若實性成分>0.8 cm或隨訪過程中結節增長超1.5 mm時應考慮手術切除。按ACR的分類標準篩選出高危結節后應不急于行外科干預,而是對其行抗感染治療,復查結果提示結節的性質大小較前無明顯變化時考慮行外科手術治療。本研究中,29例患者進行了抗炎治療和MDT會診,抗炎治療后高危結節無變化后才行手術治療。因此,鑒定高危結節不能僅靠影像學檢查,MDT會診和隨訪也是重要手段。
影像學檢查對MPNs的診斷和鑒別診斷有重要幫助,本研究中7枚良性病灶無毛刺征、分葉征等惡性腫瘤征象,因此術前影像學檢查需注意淋巴結情況,并完善全身檢查,以便于為多原發癌和轉移癌的病理診斷與鑒別診斷提供依據。本研究中有2例患者術前影像學檢查懷疑遠處轉移,其活檢病理均為浸潤性腺癌,其中1例肺癌患者發生腦轉移,目前服用靶向藥治療,另1例患者也發生肺癌腦轉移在術后29個月死亡。這也提示多原發癌和轉移癌診斷和鑒別診斷仍然具有挑戰。
對MPNs患者的手術方式目前尚無統一標準,需高質量證據對其手術方式進行指導。目前的共識為:應充分考慮高危結節的大小及所處位置,優先處理高危病灶同時兼顧次要病灶,盡可能切除高危結節2個及以上,同時盡可能保留患者肺功能:(1)所有高危病灶若位于同一肺葉內行肺葉切除,心肺功能一般時可行聯合亞肺葉切除;(2)高危病灶位于同側的多個肺葉內,根據其位置不同可同期行肺葉聯合亞肺葉切除或同期行多亞肺葉切除。有研究[11]報道,雙肺葉切除是術后心肺并發癥的危險因素,應盡量避免行除外右肺中葉的雙肺葉切除術;(3)若高危病灶位于雙側,有研究[12]認為雙側結節同期手術切除是可行的,但有研究[11]認為,雙側多發結節應分期手術且手術間隔時間需等患者心肺功能恢復。本研究中2例中年患者心肺功能尚可并經麻醉醫師評估,行同期雙側亞肺葉切除術;(4)肺總切除范圍總和不應超過10個肺段。日本JCOG0804/JCOG0802研究[13-14]發現對于≤2 cm、磨玻璃成分為主的孤立性肺結節,在保證足夠切緣的情況下,亞肺葉切除應當被推薦為首選手術方式。MPNs更需注重患者肺功能的保留,亞肺葉切除術是可供選擇的治療方式。
目前MPNs是否需行系統性淋巴結清掃尚無統一標準。既往有研究[15-16]表明,MPNs多為早期癌,發生淋巴結轉移的可能性較小,可行選擇性淋巴結采樣來評估是否存在淋巴結轉移。本研究對41例患者行系統性淋巴結清掃,對56例患者行淋巴結采樣,結果顯示均未查見淋巴結轉移。對于孤立性磨玻璃結節,有文獻[17]報道可不進行淋巴結清掃,但對于MPNs而言,若考慮多原發肺癌,尤其是有剩余病灶的患者,應淋巴結采樣或系統性淋巴結清掃。淋巴結采樣是一種可供選擇的方式。
MPNs可能為多原發肺癌或肺內轉移癌,然而多原發肺癌與肺癌肺內轉移的預后截然不同[18-19]。應結合影像學檢查、術中冰凍病理及淋巴結病理綜合判斷是否為多原發肺癌。有文獻[20]報道多原發肺癌病灶之間PET-CT標準攝取值的差異較肺內轉移癌更大,但PET-CT對于不含實性成分的結節診斷仍有局限性[21-23]。MPNs與孤立性肺結節具有相似的影像學表現[24],如毛刺征、分葉征等。既往多個研究[1,25]報道,肺內轉移癌影像學多位于中下肺野,貼近胸膜,多呈圓形或類圓形,表面光滑,邊界較清楚。術后病理類型對判斷是否為多原發肺癌有鑒別意義,不同病灶腺癌亞型(如貼壁型、乳頭型、實體型等不同起源)對其診斷有幫助。據文獻報道病理類型為原位腺癌或微浸潤腺癌極少出現轉移[26],本研究中約半數患者術后病理提示至少1個結節為原位腺癌或微浸潤腺癌。Asmar等[27]分析肺腺癌表皮生長因子受體(epidermal growth factor receptor,EGFR)、鼠類肉瘤病毒癌基因、TP53等常見驅動基因突變狀態發現驅動基因表型不同的病灶為多原發癌,若肺內各病灶具有相同的基因表型即為肺內轉移癌,但需除外野生型突變。同樣,Yang等[28]也證實了其結果,肺內轉移患者基因突變的一致率為96%。然而有研究[29]發現,肺內轉移癌存在分子異質性,原發病灶與轉移病灶EGFR基因突變不一致率在27%~33%之間。本研究對部分患者的兩處腺癌分別行基因檢測發現腺癌病灶之間的基因突變類型均不一致。隨著新一代測序[30]等新興檢測方法的不斷發展,未來有望在分子層面鑒別多原發肺癌與肺內轉移癌。
生存分析顯示,MPNs患者預后良好,2年DFS率為92.1%,2年OS率為100.0%,較國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)[31]短期預后好,可能是因為本研究高危結節TNM分期較早。Ishikawa等[32]的研究發現,病灶位于雙側的患者預后差,與本研究不同,可能是因為本研究隨訪時間不夠。患者新發結節仍然具有原發癌的影像學征象。本研究通過隨訪發現新發肺結節并不影響患者的預后。本研究顯示不同手術方式具有相同的預后(P=0.876),因此MPNs的手術方式應盡可能保留患者肺功能,采用多肺段或楔形完整切除高危病灶,具有殘余病灶對預后無影響(P=0.782),1例雙鱗癌患者目前未發現轉移或復發。不同腺癌病理組合亞型具有相同的預后(P=0.913),這與其它研究[33]結果相反,究其原因或許是本研究患者多以非實性病灶為主。本研究對低危結節的處理方式為隨訪,術后殘余結節并不影響患者預后。
本研究的主要局限性在于:(1)本研究為單中心回顧性研究,可供研究的病例相對較少,存在選擇偏倚;(2)隨訪時間較短;(3)研究中進行基因檢測的患者比例較低。
綜上所述,MPNs應根據高危結節數量及位置制定手術方案,盡量切除高危結節,至少應切除2枚以上結節以明確診斷。MPNs具有良好的預后,新發結節或結節增長并不影響患者長期生存。
利益沖突:無。
作者貢獻:張崎負責論文撰寫;郭玲、高心負責數據整理;謝少華、向潤、莊翔負責研究設計和論文審閱;李強負責對文章的知識性內容作批評性審閱。
近年來,多層螺旋計算機斷層掃描(computed tomography,CT)廣泛應用于肺癌的早期篩查[1],多發肺結節(multiple pulmonary nodules,MPNs)檢出率逐漸升高。有研究發現約半數的肺癌篩查患者存在MPNs[2]。Fleischner指南[3]中對于MPNs推薦使用最可疑的結節進行管理,但該指南無具體的外科介入診療時機。肺結節診治中國專家共識[4]建議對各個病灶進行獨立評估,并隨訪各個病灶的變化,選擇性局部切除變化明顯的病灶,若對MPNs患者分類和選擇最佳治療存在困難時,建議多學科討論(multi-disciplinary treatment,MDT)。在治療方式上,選擇外科手術作為MPNs治療方案的報道越來越多[5-6],外科治療的基本原則為主病灶優先同時兼顧次要病灶,但淋巴結清掃方式及剩余結節的處理方式目前尚無高質量證據指導。為此,本研究總結了在我科行手術治療的MPNs患者的臨床病理特征及短期隨訪資料,分析MPNs的診斷、鑒別診斷及外科治療的近期療效。
1 資料與方法
1.1 臨床資料
收集2018—2020年我院單一病區具有完整臨床資料的MPNs患者的外科治療及短期預后資料。納入隨訪的病例符合以下標準:(1)患者CT提示MPNs,若結節<1.5 cm抗炎治療2周或觀察,3個月后復查,若結節≥1.5 cm,經抗炎治療2周,1個月后復查;(2)經MDT討論后高度懷疑早期肺癌;(3)術后病理診斷為非小細胞癌。依據MPNs在CT縱隔窗上的表現類型分為磨玻璃結節、部分實性結節、實性結節及其它類型。按美國放射學院(American College of Radiology,ACR)制定的肺結節診斷分級系統[7],4A類及以上定義為高危結節,包括部分實性結節總直徑≥6 mm,具有毛刺征、分葉征、血管集束征,1年內磨玻璃結節大小翻倍,區域淋巴結腫大等。本研究的主要結局指標為MPNs患者的短期預后及其影響因素,次要結局指標為MPNs患者病灶位置分布、病理組合類型。
1.2 手術方案
根據患者全身情況、高危病灶的影像學定位和術中冰凍病理結果綜合制定手術方案。病灶位于同側者優先考慮同時切除高危病灶,所有高危病灶位于同一肺葉時,若患者心肺功能尚可,行肺葉切除術;若患者心肺功能耐受差時,行亞肺葉切除所有高危病灶。若高危病灶位于同側不同肺葉時,充分考慮高危病灶大小及位置并結合術中冰凍病理行肺葉聯合亞肺葉切除術或多亞肺葉切除術。由于中葉對肺功能影響較小,高危病灶位于右肺中葉內行雙肺葉切除。位于雙側者則根據影像學表現選擇同期切除或分期切除,患者全身情況及心肺功能可耐受同期手術時行亞肺葉+亞肺葉切除,患者心肺功能一般時則考慮分期手術。根據影像學檢查及術中冰凍病理決定系統性淋巴結清掃或淋巴結采樣,術中冰凍病理結果為非原位腺癌或微浸潤腺癌時優先考慮行系統性淋巴結清掃術。
1.3 診斷及鑒別診斷
MPNs的診斷主要通過術后病理確定,若術后病理提示多個結節均為惡性,則需鑒別肺內轉移癌與多原發肺癌。多原發肺癌的診斷參考Martini-Melamed診斷標準[8]:(1)病灶位于不同部位,互相獨立;(2)不同病灶組織學類型不同;(3)組織學類型相同時需滿足以下條件:1)病灶位于不同肺段、肺葉或雙側肺;2)不同病灶原位癌起源不同;3)共同引流淋巴結無轉移及無肺外轉移。由于原位腺癌與微浸潤腺癌極少出現轉移,術后病理含原位腺癌或微浸潤腺癌可初步考慮為多原發肺癌[9]。
1.4 隨訪
采用電話術后隨訪,隨訪日期截至2022年4月。無病生存期(disease-free survival,DFS)定義為末次手術日期至腫瘤復發、新發結節、殘余結節增大或末次影像學隨訪無疾病進展的時間。總生存期(overall survival,OS)的計算從首次手術日期開始至死亡當天或末次隨訪時間。
1.5 統計學分析
采用SPSS 26.0軟件對數據進行統計學分析。計量資料使用均數±標準差( ±s)或中位數及范圍描述。分類資料用例數及百分比描述。采用χ2檢驗進行率的比較。生存分析選擇Kaplan-Meier檢驗。檢驗水準α=0.05。
±s)或中位數及范圍描述。分類資料用例數及百分比描述。采用χ2檢驗進行率的比較。生存分析選擇Kaplan-Meier檢驗。檢驗水準α=0.05。
1.6 倫理審查
本研究已通過四川省腫瘤醫院倫理委員會批準,審批號:SCCHEC-02-2021-035。
2 結果
2.1 患者一般資料
共收集到99例MPNs患者臨床病理資料,其中2例患者術前影像學檢查考慮肺外轉移,因此本研究共納入97例患者,其中女67例(69.1%)、男30例(30.9%)。平均發病年齡(56.1±10.0)歲。患者一般資料見表1。24例患者具有惡性腫瘤家族史(24.8%)。97例患者在CT上共發現260枚病灶,包括雙發病灶62例,三發病灶22例,四發病灶4例,四發病灶以上9例;其中213枚高危病灶,純磨玻璃病灶89枚,部分實性病灶81枚,純實性病灶7枚。37枚病灶具有毛刺征,14枚病灶具有分葉征,13枚具有血管束征,213枚病灶均無圓形或類圓形征象。病灶位于同側肺者85例,其中同一肺葉49例,同側肺不同肺葉36例,病灶位于雙側肺者12例。平均主病灶大小(1.5±0.7)cm。不同性別(P=0.211)、年齡(P=0.537)、家族史(P=0.597)、吸煙史(P=0.198)及飲酒史(P=0.563)患者高危病灶是否位于同一肺葉差異無統計學意義。高危病灶的位置分布與臨床病理特征關系見表2。
 ]
]
2.2 手術結果
所有患者均接受胸腔鏡手術,其中5例為胸腔鏡輔助小切口手術。87例患者接受同期手術,其中3例行雙側同期手術,10例先行單側肺手術,平均間隔5.2(4~10)個月后行對側肺手術。手術方式包括肺葉切除術、肺段切除術及楔形切除術,亞肺葉切除術切緣距病灶≥2 cm。其中37例病灶位于同一肺葉患者接受肺葉切除術,12例病灶位于相同肺葉患者接受聯合亞肺葉切除術,13例位于同側不同肺葉患者行高危病灶肺葉切除和次要病灶亞肺葉切除,1例同期行單側肺葉+對側亞肺葉切除術,2例同期行雙側亞肺葉切除術。由于右肺中葉對肺功能的影響相對較小,本研究的5例患者接受包括右肺中葉在內的雙肺葉切除;見表3。手術切除所有高危病灶,切除全部病灶者71例,有殘余病灶者26例,共處理病灶213枚(81.9%),殘余結節47枚。41例患者完成系統性淋巴結清掃,56例患者完成淋巴結采樣,97例患者共清掃1 018枚淋巴結。首次手術后中位住院時間5(3~16)d,無圍術期死亡病例。
2.3 病理資料
97例患者術后病理至少有1個結節為惡性腫瘤,90例患者結節均為惡性腫瘤,7例患者兼有良性病灶。將213枚病灶進行病理分型,其中鱗癌2枚,良性病灶7枚,原位腺癌24枚,微浸潤腺癌52枚,浸潤性腺癌127枚,腺癌占比高達95.7%。送檢全部淋巴結均未查見轉移。手術及病理資料見表3。術后病理含原位腺癌或微浸潤腺癌50例,僅含浸潤性腺癌46例,最常見的病理組合為腺癌-腺癌(96例),鱗癌-鱗癌組合1例。參考多原發肺癌診斷標準,診斷為多原發肺癌97例,未見轉移癌。97例患者中主病灶ⅠA1期33例,ⅠA2期44例。兩種病理組合在年齡上差異具有統計學意義(χ2=9.938,P=0.002),在性別(P=0.167)、家族史(P=0.238)、吸煙史(P=0.068)及飲酒史(P=0.440)上差異無統計學意義;見表4。
2.4 隨訪結果
所有患者術后中位隨訪時間為24(18~50)個月,隨訪率為94.8%。隨訪過程中發現11例患者新發肺結節(新發結節定義為新出現的直徑≥3 mm肺結節,經抗炎治療后仍然存在),術后新發結節曲線見圖1。含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌的生存曲線見圖2,含浸潤性腺癌與僅含原位腺癌或微浸潤腺癌的生存曲線見圖3。術后2年、3年DFS率分別為92.1%和81.2%,術后2年、3年OS率均為100.0%。6例患者隨訪過程中胸部CT發現新發結節,4例患者在隨訪過程中出現結節增長,平均增長4 mm。不同性別、年齡、家族史、吸煙飲酒史、高危病灶最大徑、高危病灶是否位于同側、高危病灶是否位于相同肺葉、病理組合類型、殘余病灶、高危結節數量及手術方式患者的DFS率差異無統計學意義;見表5。
 圖1
97例多發肺結節患者無病生存曲線
圖1
97例多發肺結節患者無病生存曲線
 圖2
含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌患者生存曲線
圖2
含原位腺癌或微浸潤腺癌與僅含浸潤性腺癌患者生存曲線
 圖3
含浸潤性腺癌與不浸潤腺癌患者生存曲線
圖3
含浸潤性腺癌與不浸潤腺癌患者生存曲線
3 討論
近年來,如何做好MPNs患者的全程管理成為臨床醫師研究的重點之一。MPNs手術時機的選擇,多個指南不盡相同,但都提出應先篩選出高危結節后再行手術治療。2020年美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)肺癌篩查指南[10]指出:對于單發磨玻璃結節,隨訪中大小性質穩定,即使結節>2 cm也可持續觀察,就部分實性結節而言,若實性成分>0.8 cm或隨訪過程中結節增長超1.5 mm時應考慮手術切除。按ACR的分類標準篩選出高危結節后應不急于行外科干預,而是對其行抗感染治療,復查結果提示結節的性質大小較前無明顯變化時考慮行外科手術治療。本研究中,29例患者進行了抗炎治療和MDT會診,抗炎治療后高危結節無變化后才行手術治療。因此,鑒定高危結節不能僅靠影像學檢查,MDT會診和隨訪也是重要手段。
影像學檢查對MPNs的診斷和鑒別診斷有重要幫助,本研究中7枚良性病灶無毛刺征、分葉征等惡性腫瘤征象,因此術前影像學檢查需注意淋巴結情況,并完善全身檢查,以便于為多原發癌和轉移癌的病理診斷與鑒別診斷提供依據。本研究中有2例患者術前影像學檢查懷疑遠處轉移,其活檢病理均為浸潤性腺癌,其中1例肺癌患者發生腦轉移,目前服用靶向藥治療,另1例患者也發生肺癌腦轉移在術后29個月死亡。這也提示多原發癌和轉移癌診斷和鑒別診斷仍然具有挑戰。
對MPNs患者的手術方式目前尚無統一標準,需高質量證據對其手術方式進行指導。目前的共識為:應充分考慮高危結節的大小及所處位置,優先處理高危病灶同時兼顧次要病灶,盡可能切除高危結節2個及以上,同時盡可能保留患者肺功能:(1)所有高危病灶若位于同一肺葉內行肺葉切除,心肺功能一般時可行聯合亞肺葉切除;(2)高危病灶位于同側的多個肺葉內,根據其位置不同可同期行肺葉聯合亞肺葉切除或同期行多亞肺葉切除。有研究[11]報道,雙肺葉切除是術后心肺并發癥的危險因素,應盡量避免行除外右肺中葉的雙肺葉切除術;(3)若高危病灶位于雙側,有研究[12]認為雙側結節同期手術切除是可行的,但有研究[11]認為,雙側多發結節應分期手術且手術間隔時間需等患者心肺功能恢復。本研究中2例中年患者心肺功能尚可并經麻醉醫師評估,行同期雙側亞肺葉切除術;(4)肺總切除范圍總和不應超過10個肺段。日本JCOG0804/JCOG0802研究[13-14]發現對于≤2 cm、磨玻璃成分為主的孤立性肺結節,在保證足夠切緣的情況下,亞肺葉切除應當被推薦為首選手術方式。MPNs更需注重患者肺功能的保留,亞肺葉切除術是可供選擇的治療方式。
目前MPNs是否需行系統性淋巴結清掃尚無統一標準。既往有研究[15-16]表明,MPNs多為早期癌,發生淋巴結轉移的可能性較小,可行選擇性淋巴結采樣來評估是否存在淋巴結轉移。本研究對41例患者行系統性淋巴結清掃,對56例患者行淋巴結采樣,結果顯示均未查見淋巴結轉移。對于孤立性磨玻璃結節,有文獻[17]報道可不進行淋巴結清掃,但對于MPNs而言,若考慮多原發肺癌,尤其是有剩余病灶的患者,應淋巴結采樣或系統性淋巴結清掃。淋巴結采樣是一種可供選擇的方式。
MPNs可能為多原發肺癌或肺內轉移癌,然而多原發肺癌與肺癌肺內轉移的預后截然不同[18-19]。應結合影像學檢查、術中冰凍病理及淋巴結病理綜合判斷是否為多原發肺癌。有文獻[20]報道多原發肺癌病灶之間PET-CT標準攝取值的差異較肺內轉移癌更大,但PET-CT對于不含實性成分的結節診斷仍有局限性[21-23]。MPNs與孤立性肺結節具有相似的影像學表現[24],如毛刺征、分葉征等。既往多個研究[1,25]報道,肺內轉移癌影像學多位于中下肺野,貼近胸膜,多呈圓形或類圓形,表面光滑,邊界較清楚。術后病理類型對判斷是否為多原發肺癌有鑒別意義,不同病灶腺癌亞型(如貼壁型、乳頭型、實體型等不同起源)對其診斷有幫助。據文獻報道病理類型為原位腺癌或微浸潤腺癌極少出現轉移[26],本研究中約半數患者術后病理提示至少1個結節為原位腺癌或微浸潤腺癌。Asmar等[27]分析肺腺癌表皮生長因子受體(epidermal growth factor receptor,EGFR)、鼠類肉瘤病毒癌基因、TP53等常見驅動基因突變狀態發現驅動基因表型不同的病灶為多原發癌,若肺內各病灶具有相同的基因表型即為肺內轉移癌,但需除外野生型突變。同樣,Yang等[28]也證實了其結果,肺內轉移患者基因突變的一致率為96%。然而有研究[29]發現,肺內轉移癌存在分子異質性,原發病灶與轉移病灶EGFR基因突變不一致率在27%~33%之間。本研究對部分患者的兩處腺癌分別行基因檢測發現腺癌病灶之間的基因突變類型均不一致。隨著新一代測序[30]等新興檢測方法的不斷發展,未來有望在分子層面鑒別多原發肺癌與肺內轉移癌。
生存分析顯示,MPNs患者預后良好,2年DFS率為92.1%,2年OS率為100.0%,較國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)[31]短期預后好,可能是因為本研究高危結節TNM分期較早。Ishikawa等[32]的研究發現,病灶位于雙側的患者預后差,與本研究不同,可能是因為本研究隨訪時間不夠。患者新發結節仍然具有原發癌的影像學征象。本研究通過隨訪發現新發肺結節并不影響患者的預后。本研究顯示不同手術方式具有相同的預后(P=0.876),因此MPNs的手術方式應盡可能保留患者肺功能,采用多肺段或楔形完整切除高危病灶,具有殘余病灶對預后無影響(P=0.782),1例雙鱗癌患者目前未發現轉移或復發。不同腺癌病理組合亞型具有相同的預后(P=0.913),這與其它研究[33]結果相反,究其原因或許是本研究患者多以非實性病灶為主。本研究對低危結節的處理方式為隨訪,術后殘余結節并不影響患者預后。
本研究的主要局限性在于:(1)本研究為單中心回顧性研究,可供研究的病例相對較少,存在選擇偏倚;(2)隨訪時間較短;(3)研究中進行基因檢測的患者比例較低。
綜上所述,MPNs應根據高危結節數量及位置制定手術方案,盡量切除高危結節,至少應切除2枚以上結節以明確診斷。MPNs具有良好的預后,新發結節或結節增長并不影響患者長期生存。
利益沖突:無。
作者貢獻:張崎負責論文撰寫;郭玲、高心負責數據整理;謝少華、向潤、莊翔負責研究設計和論文審閱;李強負責對文章的知識性內容作批評性審閱。