引用本文: 張立巖, 孫新, 田丹, 徐睿, 雷昊, 艾津輝, 趙博, 陳繼營, 柴偉, 馬守成, 劉偉佳, 申斯原. 兔早期激素性股骨頭缺血性壞死模型建立及其MRI與病理特征研究. 中國修復重建外科雜志, 2015, 29(10): 1240-1243. doi: 10.7507/1002-1892.20150269 復制
在我國激素性股骨頭缺血性壞死發病率占非創傷性股骨頭缺血性壞死的首位,由于缺乏有效的預防和診治手段,患者在發病后可迅速發生股骨頭塌陷,造成嚴重的髖關節功能障礙,因此早期診斷和治療是影響股骨頭缺血性壞死預后的主要因素[1-2]。研究表明,激素引起股骨頭缺血性壞死,人和動物的反應是一致的[3],因此建立實驗性動物模型是研究早期激素性股骨頭缺血性壞死的重要手段之一。目前構建股骨頭缺血性壞死動物模型的方法較多,常用方法有單純激素誘導、同種異體血清加激素誘導、內毒素加激素誘導[4]。股骨頭缺血性壞死的主要檢查手段為X線片,但其敏感性較差;而MRI對股骨頭缺血性壞死的早期診斷具有較高敏感性,還能準確描述壞死形態和部位;組織病理學是診斷股骨頭缺血性壞死最可靠方法。本實驗采用短期、沖擊、大劑量地塞米松誘導兔股骨頭缺血性壞死模型,以MRI和組織病理學等方法對構建的動物模型進行評估,以期為研究激素性股骨頭缺血性壞死發病機制及早期防治提供可靠的動物模型。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
6月齡家兔20只,雌雄不限,體質量2~3 kg,由北華大學動物實驗中心提供。標準條件下飼養,每籠2只,適應性喂養1周后隨機分為實驗組和對照組,每組10只。
生理鹽水(四川科倫藥業股份有限公司);青霉素(華北制藥股份有限公司);地塞米松磷酸鈉注射液(鄭州卓峰制藥有限公司);EDTA脫鈣液(武漢博士德生物工程有限公司)。Signa HDXT 3.0T MRI儀、Volume Share 4 (AW4.5) 工作站(GE公司,美國)。
1.2 造模方法
實驗組動物于雙側臀肌交替注射地塞米松磷酸鈉注射液(10 mg/kg),每3天注射1次,共14次;對照組于雙側臀肌注射等量生理鹽水(10 mg/kg)。為預防感染,所有動物雙側臀肌交替注射青霉素(5 萬 U/kg),每周2次,共6周。6周后行MRI檢查、大體觀察及組織學觀察。
1.3 觀測指標
1.3.1 一般觀察
注射后觀察兩組動物食量、脫毛情況及步態變化。
1.3.2 MRI檢查
兩組隨機取3只動物,采用20%烏拉坦(4 mL/kg)耳緣靜脈注射麻醉。MRI成像由吉林中西醫結合醫院協作完成,使用Signa HDXT 3.0T MRI儀行雙后腿股骨頭掃描,并使用Volume Share 4(AW4.5)工作站進行圖像分析和審查。掃描電流150 A、電壓700 V、場強3.0 T。掃描方式:冠狀面FL/LTWI SE/LTWI,橫斷面TSE/LTWI FS。
1.3.3 大體觀察
兩組隨機取3只動物,空氣栓塞法處死后,無菌條件下取出雙后腿股骨頭,冠狀面剖開,大體觀察股骨頭軟骨及軟骨下骨形態、剖面顏色等。
1.3.4 組織學觀察
兩組隨機取3只動物,同1.3.3方法取出雙后腿股骨頭,立即置于中性甲醛溶液固定3 d,使用EDTA脫鈣液脫鈣3 d,梯度乙醇脫水,將股骨頭負重區沿冠狀面剖開,軟骨下區切取1.5 cm×1.0 cm×0.2 cm組織作石蠟切片(片厚3~5 μm),包埋,二甲苯透明,常規HE染色,光鏡下觀察。骨細胞壞死病理變化以空骨陷窩率表示,即在400倍放大率下,任選5個視野,計算空骨陷窩所占百分比。
1.4 統計學方法
采用CHISS統計軟件進行分析。數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 一般觀察
造模期間,實驗組和對照組各1只動物因意外高處墜落死亡,無其他并發癥發生。對照組動物均未出現明顯脫毛及食量、運動改變。實驗組第2周動物食量略有增加,步態正常;第4周出現少量脫毛,食量正常,體質量略減輕,跑動減少;第6周脫毛加重,食量減少,5只動物出現腹瀉,跑動頻率較前降低,并出現輕微跛行。
2.2 MRI檢查
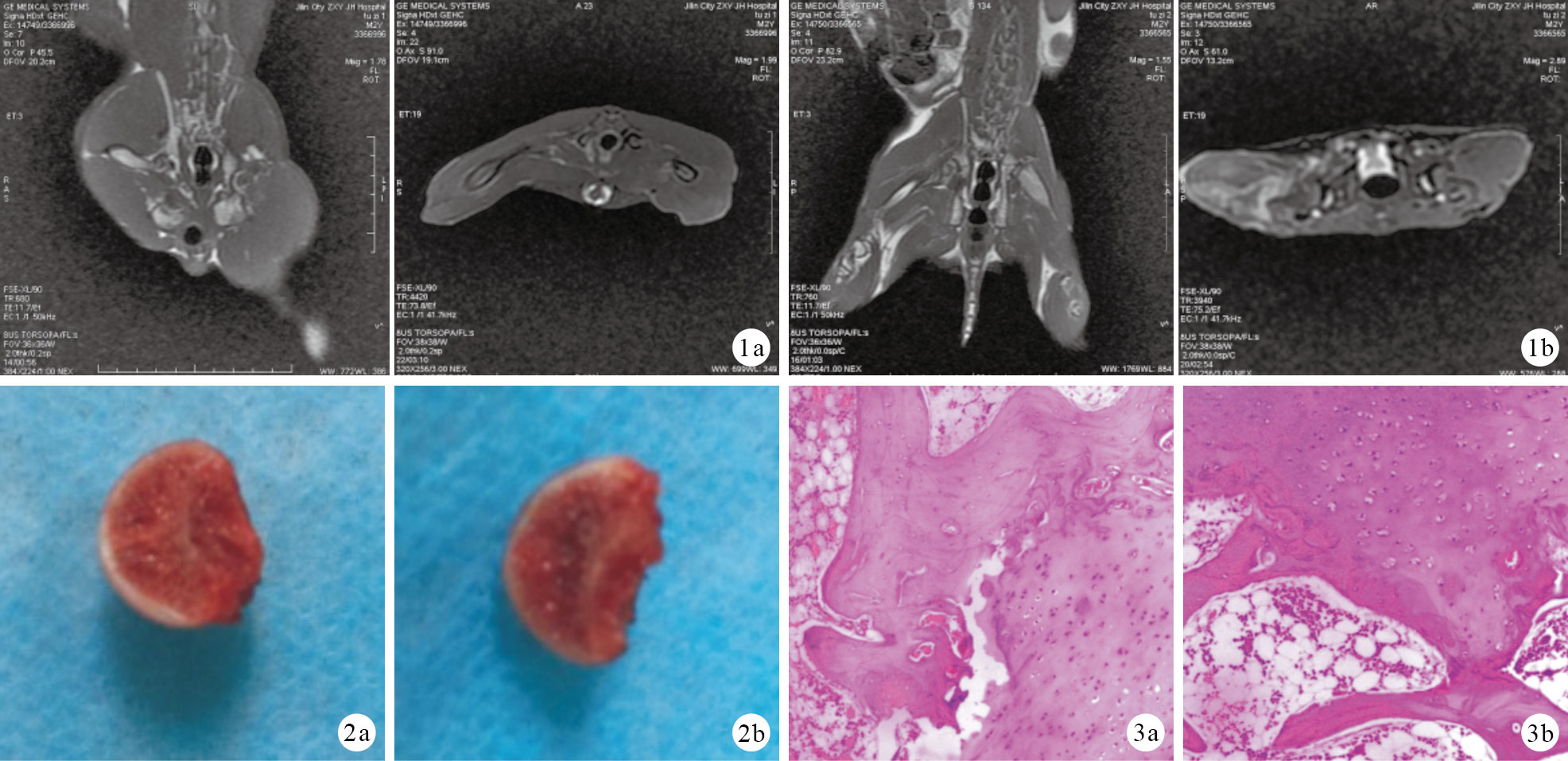
對照組雙側股骨頭形態規則,股骨頭內未見異常信號,骨小梁排列正常,雙側髖關節正常(圖 1 a)。實驗組雙側股骨頭形態欠規則,股骨頭內可見斑片狀不規則異常信號,軟骨下骨壞死、囊變,骨小梁稀疏,LTWI呈低信號,LTWI呈稍高信號,邊界模糊,信號欠均勻,雙側關節腔內可見弧形液體影;雙側髖關節對稱,關節間隙正常(圖 1 b)。
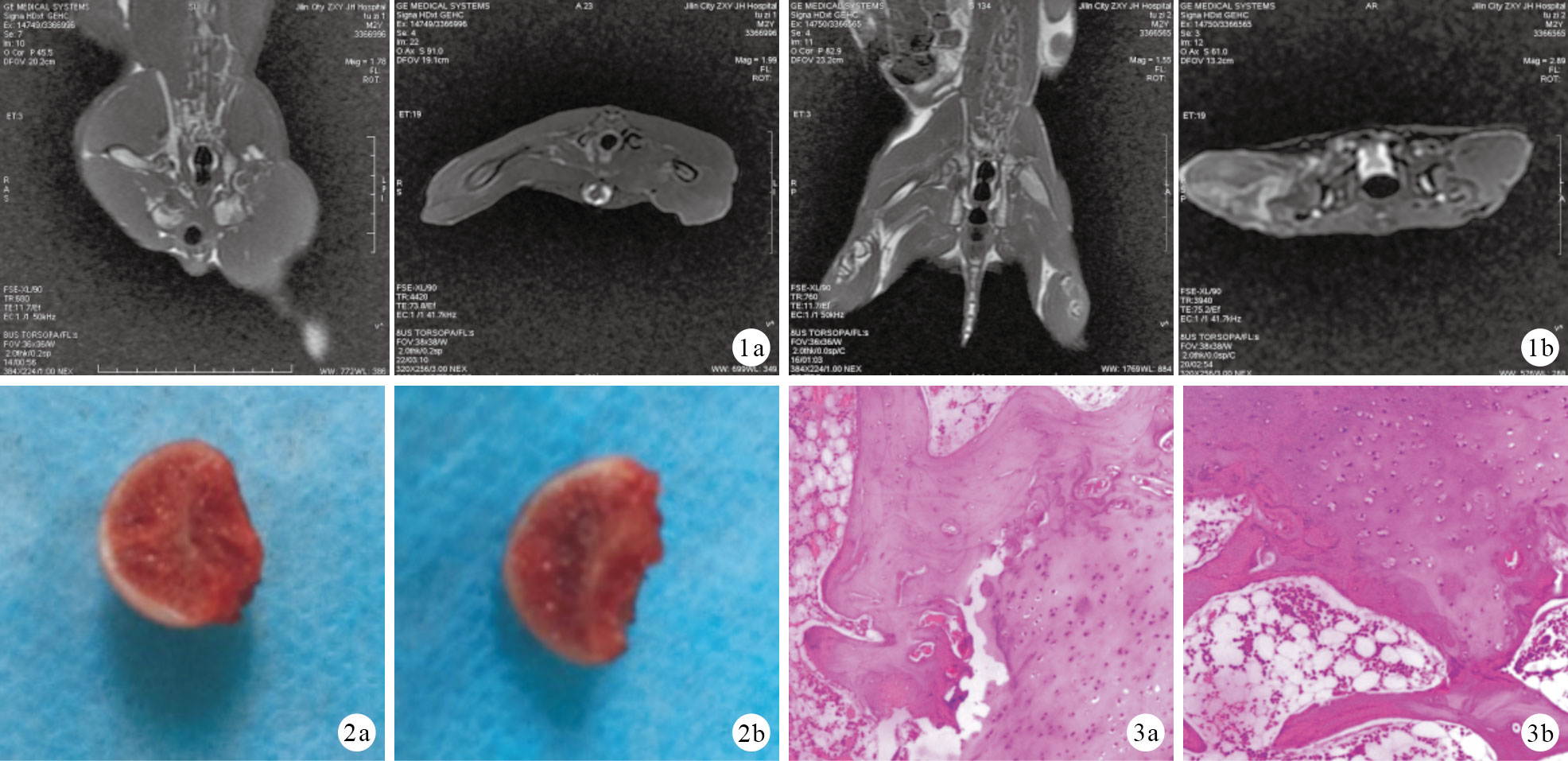 圖1
造模6周后兩組冠狀面和橫斷面MRI檢查 ? 對照組 ? 實驗組 ? ?
圖1
造模6周后兩組冠狀面和橫斷面MRI檢查 ? 對照組 ? 實驗組 ? ?2.3 大體觀察
對照組股骨頭大小形態正常,軟骨面平整、光滑,股骨頭剖面呈紅色。實驗組股骨頭軟骨表面失去光澤、變薄,可見片狀軟骨下出血、壞死,股骨頭剖面呈淺紅色。見圖 2。
2.4 組織學觀察
對照組軟骨下骨板厚而連續,毛細血管網豐富;股骨頭內骨小梁粗大,骨陷窩內骨細胞形態正常;股骨頭骨髓腔內脂肪細胞正常,紅細胞豐富,形態正常。實驗組軟骨下骨板薄,毛細血管網稀疏;骨小梁變細和稀疏,部分斷裂;骨細胞核固縮,空骨陷窩明顯增多;骨髓腔內脂肪細胞增多、增大;紅骨髓受壓變少。見圖 3。對照組和實驗組空骨陷窩率分別為8.0%±0.5%和49.0%±0.3%,比較差異有統計學意義(t=21.940,P=0.000)。
3 討論
在建立早期激素性股骨頭缺血性壞死模型研究中,關于激素種類、用量、動物死亡率、是否添加內毒素或馬血清等尚無統一標準[5-7]。內毒素[3]或馬血清[8]聯合激素誘導已成為激素性股骨頭缺血性壞死的經典造模方式,但內毒素及馬血清本身對于股骨頭缺血性壞死模型也會產生一定影響,一些監測指標可能發生改變,因此該模型主要用于股骨頭缺血性壞死治療方式的研究,不宜用于發病機制的研究[9]。常用的內毒素脂多糖是一種強烈的致炎因子,作用于機體后會引起內毒素血癥,導致動物死亡率高[10-11]。本研究單純使用地塞米松造模,其原因為地塞米松血漿蛋白結合部分較少,生物活性大,半衰期較甲潑尼龍、氫化可的松作用時間長,且經濟、使用簡便。本研究中實驗組增加了地塞米松用量,給予預實驗得出的兔可接受的最大劑量10 mg/kg,并縮短了給藥間隔時間(每3天注射1次),同時為提高動物生存率,每周2次臀肌注射青霉素。我們認為該建模方法優點為操作簡便、穩定可靠、重復性好、死亡率低,可成功誘導出兔早期激素性股骨頭缺血性壞死模型。不足在于:① 單純激素誘導造模成功時間長,Yamaguchi等[12]報道一次肌肉注射20 mg/kg甲潑尼龍,3周后對股骨和肱骨行組織病理學檢查才發現骨壞死;② 4足動物很難模擬人類股骨頭缺血性壞死的全病理過程,宜選擇鴯鹋等大型2 足動物,其與人類雙下肢負重基本類似,符合人體生物力學[13-14];③ 骨壞死病灶未局限于股骨頭,還會出現在肱骨近端等其余長骨處[9]。
早期股骨頭缺血性壞死動物模型評價常用方法為影像學檢查及組織病理學檢查。影像學檢查包括X線片、雙能X射線骨密度測量儀、Micro-CT、MRI等。X線片很難顯示小型動物股骨頭內早期變化,鎖詠梅等[15]指出其對股骨頭缺血性壞死早期診斷價值有限;雙能X射線骨密度測量僅能對股骨頭內骨密度改變進行測量評價,無法進行準確分期;Micro-CT可顯示股骨頭內微細改變,同時結合軟件定量分析骨小梁相關參數和骨密度等指標[16-17],但儀器價格較高,無法在基層單位普及;MRI是檢查股骨頭缺血性壞死最敏感的方法,診斷股骨頭缺血性壞死主要依靠常規序列,其特征性表現為LTWI上軟骨下局限性的帶狀低信號以及LTWI上的“雙線征”,即外緣為低信號,內緣為高信號,通過MRI的特征性表現可診斷早期股骨頭缺血性壞死并進行分期[15, 18-19]。依據國際骨循環研究學會(ARCO)的分期標準:0 期,活檢結果符合壞死,其余檢查正常;1 期,骨掃描和/或MRI陽性;2期,股骨頭斑片狀密度不均、硬化與囊變形成,X線片與CT無塌陷表現,MRI與骨掃描陽性,髖臼無變化;3期,正側位X線片上出現新月征;4期,關節面塌陷變扁、關節間隙狹窄、髖臼出現壞死變化、囊性變、囊腫和骨刺。實驗組MRI檢查發現兔軟骨下骨壞死、囊變,骨小梁稀疏,符合ARCO分期中的2期病變。提示MRI檢查可作為早期激素性股骨頭缺血性壞死動物模型的鑒定方式。
組織病理學是診斷骨壞死的金標準,激素性股骨頭缺血性壞死的主要病理標志是骨細胞在陷窩中消失[20]。本研究中實驗組骨小梁明顯變細、稀疏,結構紊亂,部分骨小梁斷裂不連續,陷窩內骨細胞數量明顯減少;實驗組空骨陷窩率顯著高于對照組,比較差異有統計學意義;說明實驗組動物模型符合股骨頭缺血性壞死的早期病理特征。
綜上述,采用短期、沖擊、大劑量地塞米松可成功構建兔早期激素性股骨頭缺血性壞死模型。組織病理學檢查是鑒定造模成功的最常用辦法,但為有創檢查,動物模型無法進行后續研究;MRI具有無創操作、診斷準確、可重復性、可廣泛開展的特點,在評價早期激素性股骨頭缺血性壞死模型方面優于其他影像學檢查。
在我國激素性股骨頭缺血性壞死發病率占非創傷性股骨頭缺血性壞死的首位,由于缺乏有效的預防和診治手段,患者在發病后可迅速發生股骨頭塌陷,造成嚴重的髖關節功能障礙,因此早期診斷和治療是影響股骨頭缺血性壞死預后的主要因素[1-2]。研究表明,激素引起股骨頭缺血性壞死,人和動物的反應是一致的[3],因此建立實驗性動物模型是研究早期激素性股骨頭缺血性壞死的重要手段之一。目前構建股骨頭缺血性壞死動物模型的方法較多,常用方法有單純激素誘導、同種異體血清加激素誘導、內毒素加激素誘導[4]。股骨頭缺血性壞死的主要檢查手段為X線片,但其敏感性較差;而MRI對股骨頭缺血性壞死的早期診斷具有較高敏感性,還能準確描述壞死形態和部位;組織病理學是診斷股骨頭缺血性壞死最可靠方法。本實驗采用短期、沖擊、大劑量地塞米松誘導兔股骨頭缺血性壞死模型,以MRI和組織病理學等方法對構建的動物模型進行評估,以期為研究激素性股骨頭缺血性壞死發病機制及早期防治提供可靠的動物模型。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
6月齡家兔20只,雌雄不限,體質量2~3 kg,由北華大學動物實驗中心提供。標準條件下飼養,每籠2只,適應性喂養1周后隨機分為實驗組和對照組,每組10只。
生理鹽水(四川科倫藥業股份有限公司);青霉素(華北制藥股份有限公司);地塞米松磷酸鈉注射液(鄭州卓峰制藥有限公司);EDTA脫鈣液(武漢博士德生物工程有限公司)。Signa HDXT 3.0T MRI儀、Volume Share 4 (AW4.5) 工作站(GE公司,美國)。
1.2 造模方法
實驗組動物于雙側臀肌交替注射地塞米松磷酸鈉注射液(10 mg/kg),每3天注射1次,共14次;對照組于雙側臀肌注射等量生理鹽水(10 mg/kg)。為預防感染,所有動物雙側臀肌交替注射青霉素(5 萬 U/kg),每周2次,共6周。6周后行MRI檢查、大體觀察及組織學觀察。
1.3 觀測指標
1.3.1 一般觀察
注射后觀察兩組動物食量、脫毛情況及步態變化。
1.3.2 MRI檢查
兩組隨機取3只動物,采用20%烏拉坦(4 mL/kg)耳緣靜脈注射麻醉。MRI成像由吉林中西醫結合醫院協作完成,使用Signa HDXT 3.0T MRI儀行雙后腿股骨頭掃描,并使用Volume Share 4(AW4.5)工作站進行圖像分析和審查。掃描電流150 A、電壓700 V、場強3.0 T。掃描方式:冠狀面FL/LTWI SE/LTWI,橫斷面TSE/LTWI FS。
1.3.3 大體觀察
兩組隨機取3只動物,空氣栓塞法處死后,無菌條件下取出雙后腿股骨頭,冠狀面剖開,大體觀察股骨頭軟骨及軟骨下骨形態、剖面顏色等。
1.3.4 組織學觀察
兩組隨機取3只動物,同1.3.3方法取出雙后腿股骨頭,立即置于中性甲醛溶液固定3 d,使用EDTA脫鈣液脫鈣3 d,梯度乙醇脫水,將股骨頭負重區沿冠狀面剖開,軟骨下區切取1.5 cm×1.0 cm×0.2 cm組織作石蠟切片(片厚3~5 μm),包埋,二甲苯透明,常規HE染色,光鏡下觀察。骨細胞壞死病理變化以空骨陷窩率表示,即在400倍放大率下,任選5個視野,計算空骨陷窩所占百分比。
1.4 統計學方法
采用CHISS統計軟件進行分析。數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 一般觀察
造模期間,實驗組和對照組各1只動物因意外高處墜落死亡,無其他并發癥發生。對照組動物均未出現明顯脫毛及食量、運動改變。實驗組第2周動物食量略有增加,步態正常;第4周出現少量脫毛,食量正常,體質量略減輕,跑動減少;第6周脫毛加重,食量減少,5只動物出現腹瀉,跑動頻率較前降低,并出現輕微跛行。
2.2 MRI檢查
對照組雙側股骨頭形態規則,股骨頭內未見異常信號,骨小梁排列正常,雙側髖關節正常(圖 1 a)。實驗組雙側股骨頭形態欠規則,股骨頭內可見斑片狀不規則異常信號,軟骨下骨壞死、囊變,骨小梁稀疏,LTWI呈低信號,LTWI呈稍高信號,邊界模糊,信號欠均勻,雙側關節腔內可見弧形液體影;雙側髖關節對稱,關節間隙正常(圖 1 b)。
 圖1
造模6周后兩組冠狀面和橫斷面MRI檢查 ? 對照組 ? 實驗組 ? ?
圖1
造模6周后兩組冠狀面和橫斷面MRI檢查 ? 對照組 ? 實驗組 ? ?2.3 大體觀察
對照組股骨頭大小形態正常,軟骨面平整、光滑,股骨頭剖面呈紅色。實驗組股骨頭軟骨表面失去光澤、變薄,可見片狀軟骨下出血、壞死,股骨頭剖面呈淺紅色。見圖 2。
2.4 組織學觀察
對照組軟骨下骨板厚而連續,毛細血管網豐富;股骨頭內骨小梁粗大,骨陷窩內骨細胞形態正常;股骨頭骨髓腔內脂肪細胞正常,紅細胞豐富,形態正常。實驗組軟骨下骨板薄,毛細血管網稀疏;骨小梁變細和稀疏,部分斷裂;骨細胞核固縮,空骨陷窩明顯增多;骨髓腔內脂肪細胞增多、增大;紅骨髓受壓變少。見圖 3。對照組和實驗組空骨陷窩率分別為8.0%±0.5%和49.0%±0.3%,比較差異有統計學意義(t=21.940,P=0.000)。
3 討論
在建立早期激素性股骨頭缺血性壞死模型研究中,關于激素種類、用量、動物死亡率、是否添加內毒素或馬血清等尚無統一標準[5-7]。內毒素[3]或馬血清[8]聯合激素誘導已成為激素性股骨頭缺血性壞死的經典造模方式,但內毒素及馬血清本身對于股骨頭缺血性壞死模型也會產生一定影響,一些監測指標可能發生改變,因此該模型主要用于股骨頭缺血性壞死治療方式的研究,不宜用于發病機制的研究[9]。常用的內毒素脂多糖是一種強烈的致炎因子,作用于機體后會引起內毒素血癥,導致動物死亡率高[10-11]。本研究單純使用地塞米松造模,其原因為地塞米松血漿蛋白結合部分較少,生物活性大,半衰期較甲潑尼龍、氫化可的松作用時間長,且經濟、使用簡便。本研究中實驗組增加了地塞米松用量,給予預實驗得出的兔可接受的最大劑量10 mg/kg,并縮短了給藥間隔時間(每3天注射1次),同時為提高動物生存率,每周2次臀肌注射青霉素。我們認為該建模方法優點為操作簡便、穩定可靠、重復性好、死亡率低,可成功誘導出兔早期激素性股骨頭缺血性壞死模型。不足在于:① 單純激素誘導造模成功時間長,Yamaguchi等[12]報道一次肌肉注射20 mg/kg甲潑尼龍,3周后對股骨和肱骨行組織病理學檢查才發現骨壞死;② 4足動物很難模擬人類股骨頭缺血性壞死的全病理過程,宜選擇鴯鹋等大型2 足動物,其與人類雙下肢負重基本類似,符合人體生物力學[13-14];③ 骨壞死病灶未局限于股骨頭,還會出現在肱骨近端等其余長骨處[9]。
早期股骨頭缺血性壞死動物模型評價常用方法為影像學檢查及組織病理學檢查。影像學檢查包括X線片、雙能X射線骨密度測量儀、Micro-CT、MRI等。X線片很難顯示小型動物股骨頭內早期變化,鎖詠梅等[15]指出其對股骨頭缺血性壞死早期診斷價值有限;雙能X射線骨密度測量僅能對股骨頭內骨密度改變進行測量評價,無法進行準確分期;Micro-CT可顯示股骨頭內微細改變,同時結合軟件定量分析骨小梁相關參數和骨密度等指標[16-17],但儀器價格較高,無法在基層單位普及;MRI是檢查股骨頭缺血性壞死最敏感的方法,診斷股骨頭缺血性壞死主要依靠常規序列,其特征性表現為LTWI上軟骨下局限性的帶狀低信號以及LTWI上的“雙線征”,即外緣為低信號,內緣為高信號,通過MRI的特征性表現可診斷早期股骨頭缺血性壞死并進行分期[15, 18-19]。依據國際骨循環研究學會(ARCO)的分期標準:0 期,活檢結果符合壞死,其余檢查正常;1 期,骨掃描和/或MRI陽性;2期,股骨頭斑片狀密度不均、硬化與囊變形成,X線片與CT無塌陷表現,MRI與骨掃描陽性,髖臼無變化;3期,正側位X線片上出現新月征;4期,關節面塌陷變扁、關節間隙狹窄、髖臼出現壞死變化、囊性變、囊腫和骨刺。實驗組MRI檢查發現兔軟骨下骨壞死、囊變,骨小梁稀疏,符合ARCO分期中的2期病變。提示MRI檢查可作為早期激素性股骨頭缺血性壞死動物模型的鑒定方式。
組織病理學是診斷骨壞死的金標準,激素性股骨頭缺血性壞死的主要病理標志是骨細胞在陷窩中消失[20]。本研究中實驗組骨小梁明顯變細、稀疏,結構紊亂,部分骨小梁斷裂不連續,陷窩內骨細胞數量明顯減少;實驗組空骨陷窩率顯著高于對照組,比較差異有統計學意義;說明實驗組動物模型符合股骨頭缺血性壞死的早期病理特征。
綜上述,采用短期、沖擊、大劑量地塞米松可成功構建兔早期激素性股骨頭缺血性壞死模型。組織病理學檢查是鑒定造模成功的最常用辦法,但為有創檢查,動物模型無法進行后續研究;MRI具有無創操作、診斷準確、可重復性、可廣泛開展的特點,在評價早期激素性股骨頭缺血性壞死模型方面優于其他影像學檢查。