引用本文: 陳莎, 徐才剛. 地西他濱聯合信迪利單抗治療難治性蕈樣肉芽腫一例. 華西醫學, 2023, 38(9): 1444-1448. doi: 10.7507/1002-0179.202306007 復制
病例介紹 患者,男,58 歲,主因“頸、腹、臀背部皮膚多處包塊 4 年,皮疹 5 個月”于 2021 年 5 月 26 日就診于四川大學華西醫院。2017 年患者無明顯誘因出現頸、腹、臀背部皮膚多處包塊,當地醫院按“皮疹”治療,病情進行性加重;2021 年 1 月患者皮膚包塊增多、增大,伴頭頸、胸背部、臀部散在紅色皮疹,局部皮膚破潰、滲液。患者既往無特殊病史。入院體格檢查:雙側頸部、腋窩、腹股溝區可捫及數枚腫大淋巴結,最大直徑約 2 cm,表面光滑、活動性好,質韌;頭頸部、腹部、臀背部彌漫分布紅色皮損(圖1),伴破潰、滲液;胸骨無壓痛,腹軟,肝脾肋下未觸及;雙下肢無水腫。實驗室檢查:白細胞計數 24.65×109/L,中性粒細胞計數 14.3×109/L,淋巴細胞計數 6.4×109/L,嗜酸性粒細胞計數 3.89×109/L,血紅蛋白 146 g/L,血小板計數 275×109/L,β2 微球蛋白 2.95 mg/L,乳酸脫氫酶 557 U/L,血清 EB 病毒 DNA 1.25×103 copies/mL。腹部皮膚活檢:表皮灶性壞死,余表皮部分角化不全棘層不規則增生,真皮全層小血管及皮膚附屬器周圍成片淋巴細胞、嗜酸性粒細胞、組織細胞及少量中性粒細胞浸潤,部分區域似有上皮樣肉芽腫形成,其中較多淋巴細胞較大、核形不規則;腹部皮膚活檢免疫組織化學檢測:CD3(+)、CD5(+)、CD45(+)、CD20(–)、CD68(–)、CD79α(–)、Ki-67(+,局灶高表達)、末端轉移酶(–)、CD56(–);結合形態學和免疫組織化學,患者腰腹部皮膚符合 T 細胞淋巴瘤(圖2)。頸部淋巴結活檢:淋巴結結構部分破壞,濾泡結構尚存在,濾泡間區見大細胞浸潤,細胞的細胞質豐富,呈嗜酸性,散在分布嗜酸性粒細胞;頸部淋巴結免疫組織化學檢測結果:大細胞 CD30(部分+,15%~20%)、CD2(+)、CD3(+)、CD5(+)、CD7(+)、上皮細胞膜抗原(+)、CD4(+)、Ki-67(+,50%)、CD21(–)、程序性死亡受體 1(programmed death 1, PD-1)(–)、CD20(–)、間變性淋巴瘤激酶(–)、P63(–)、CD15(–)、粒酶 B(–)、P53(+,10%),濾泡樹突狀細胞 CD21(+),病理學示成熟 T 細胞淋巴瘤;考慮原發皮膚 T 細胞淋巴瘤(cutaneous T cell lymphoma, CTCL)累及,蕈樣肉芽腫(mycosis fungoides, MF)可能性大(圖3)。骨髓細胞學:嗜酸性粒細胞增高占 17.5%。流式細胞學:淋巴細胞以異常 T 細胞為主(CD4+ CD25+)。
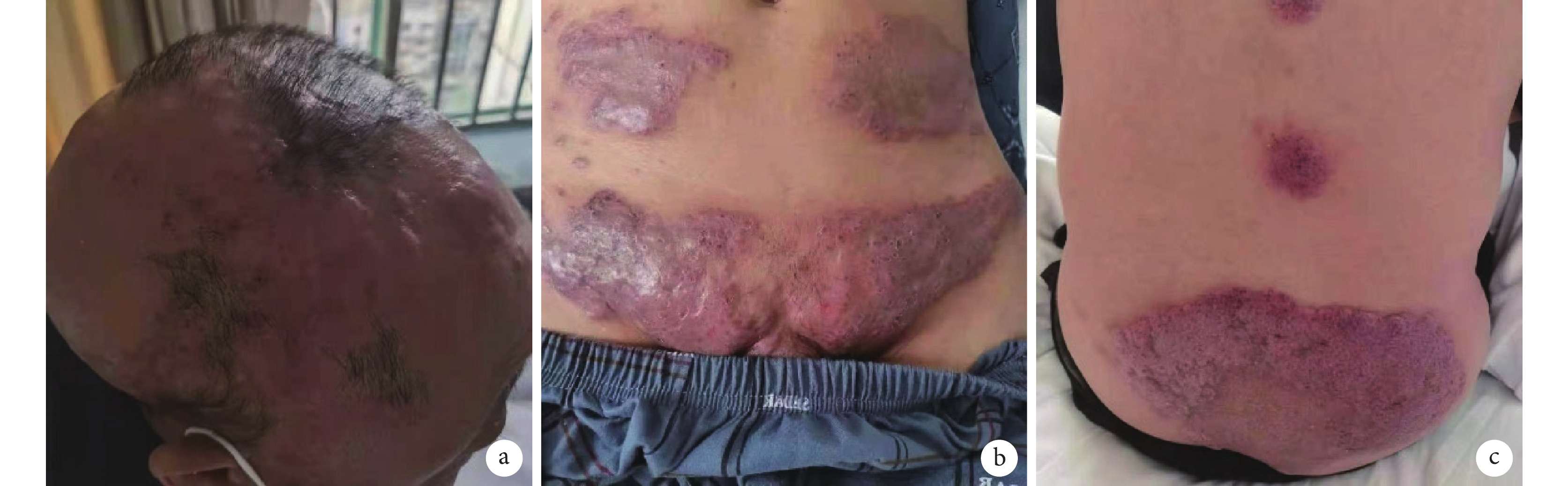
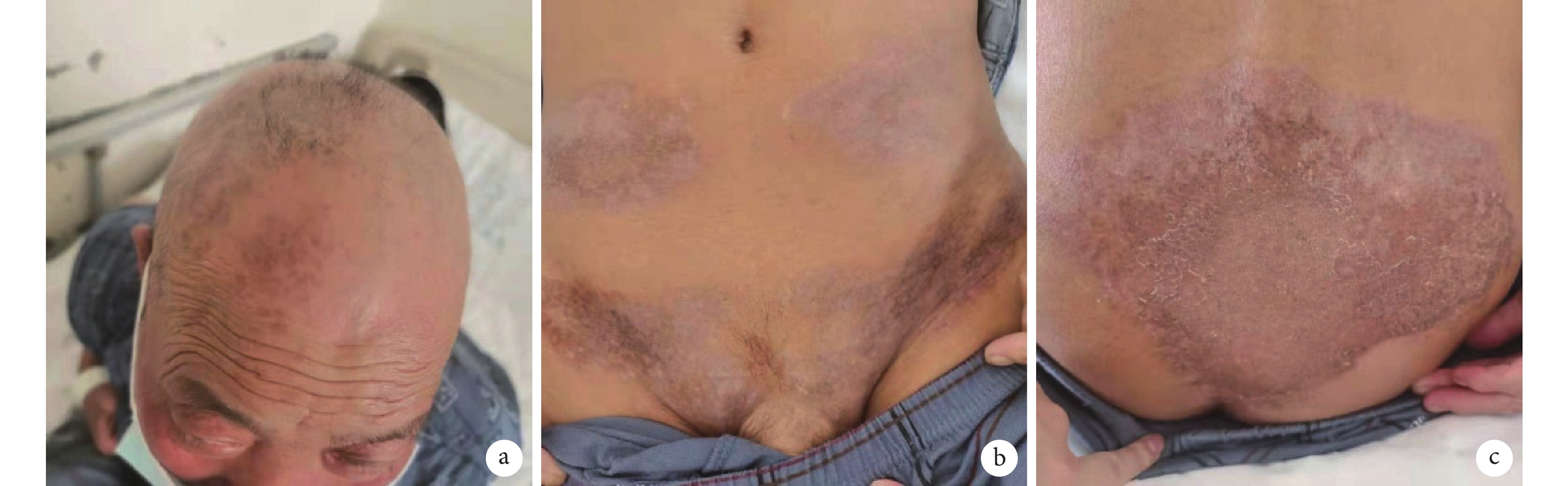
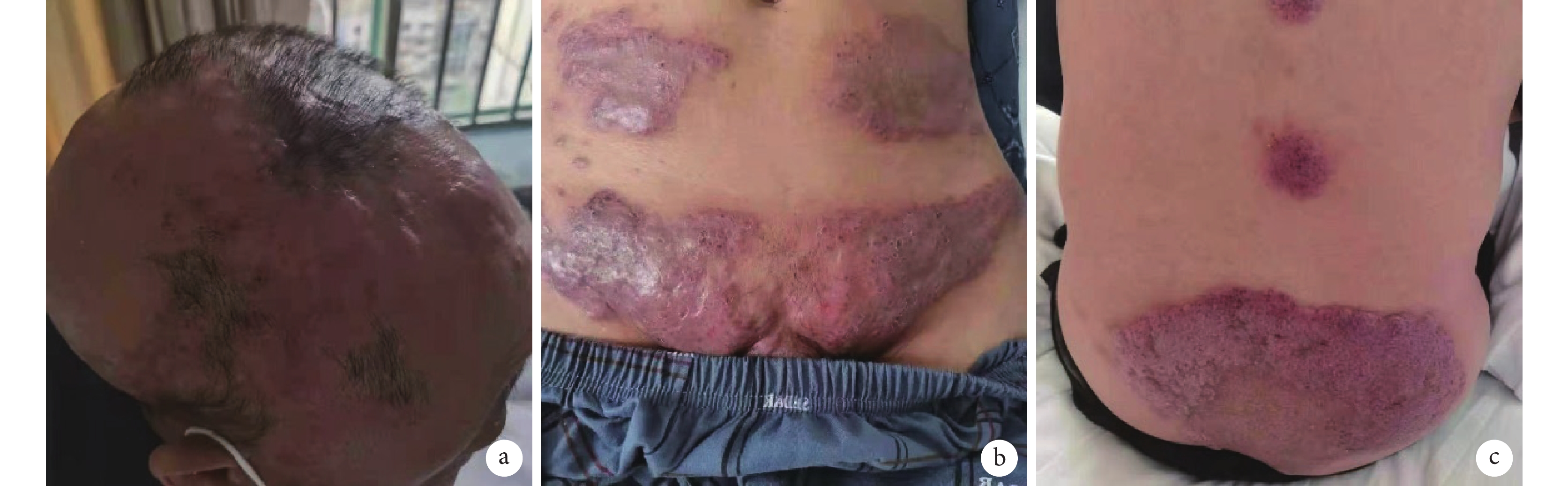 圖1
患者治療前皮損彩色像
圖1
患者治療前皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚均可見呈團塊狀分布的淡紅色、暗紅色斑塊,其中臀部皮損表面可見少量鱗屑
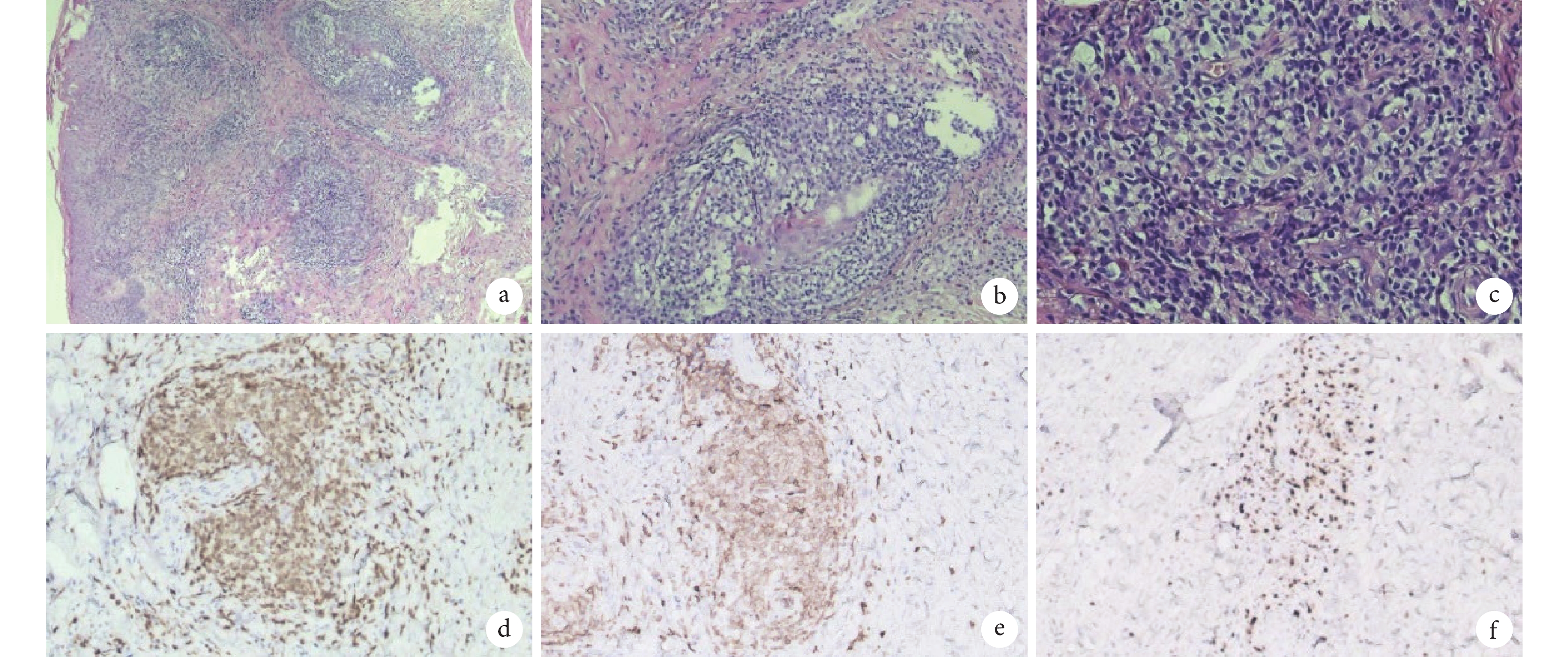
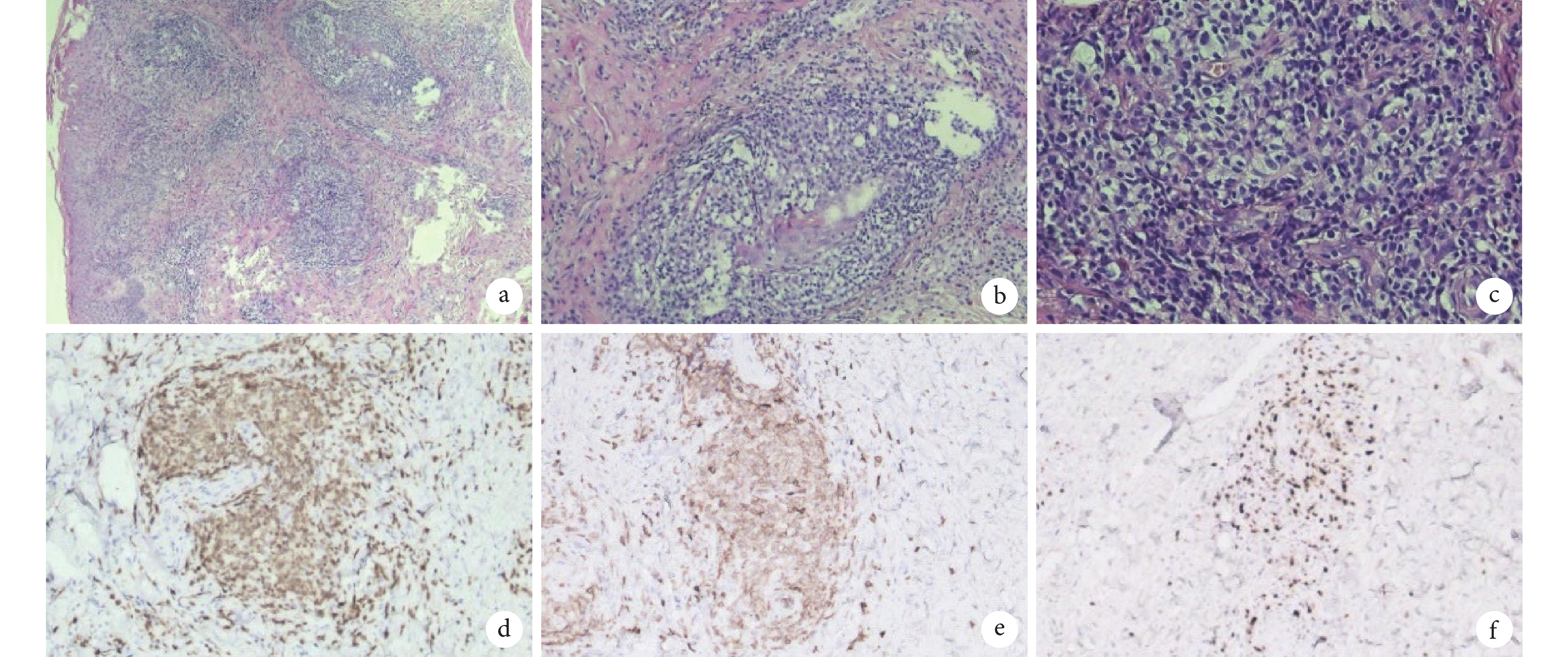 圖2
患者腹部皮膚活檢病理圖像
圖2
患者腹部皮膚活檢病理圖像
a. 腫瘤性淋巴細胞聚集成團(HE ×40); b. 腫瘤性淋巴細胞在纖維間質中呈浸潤性生長模式(HE ×100);c. 腫瘤性淋巴細胞小到中等大小,細胞核不規則,部分細胞質透明(HE ×200);d. 腫瘤性淋巴細胞細胞膜/質 CD3 陽性(EnVision ×100);e. 腫瘤性淋巴細胞細胞膜 CD5 陽性(EnVision ×100);f. 腫瘤性淋巴細胞細胞核 Ki-67 陽性(EnVision ×100)。HE:蘇木精-伊紅染色;EnVision:EnVision 二步法染色
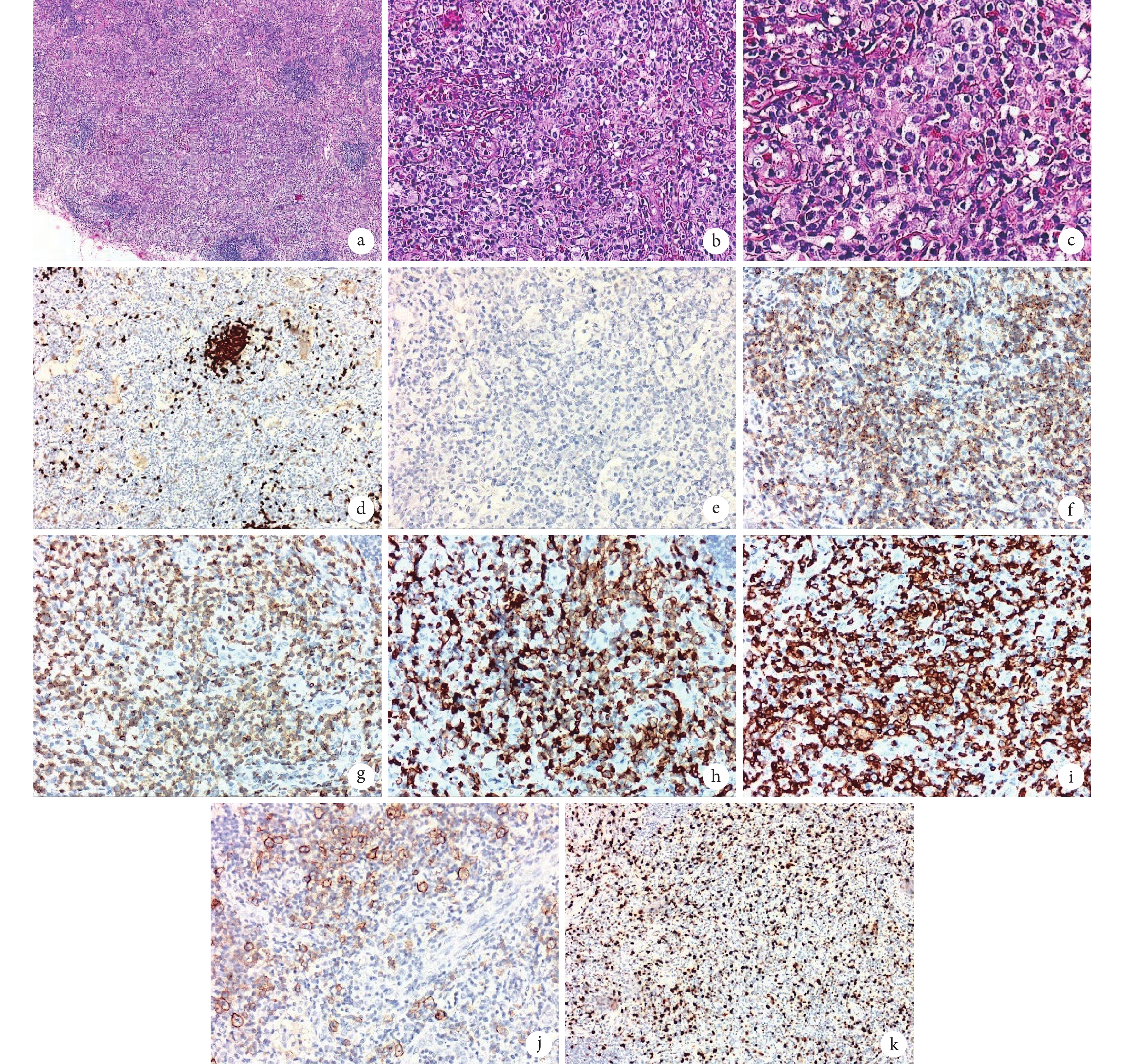 圖3
患者頸部淋巴結活檢病理圖像
圖3
患者頸部淋巴結活檢病理圖像
a. 淋巴結結構大部分破壞,中等及中等偏大異型淋巴細胞浸潤,可見殘存淋巴濾泡(HE ×40);b. 增生小血管周見中等及中等偏大異型淋巴細胞浸潤,背景散在嗜酸性粒細胞(HE ×200);c. 中等及中等偏大異型淋巴細胞,背景散在嗜酸性粒細胞(HE ×400);d. CD20 檢測顯示中等及中等偏大異型淋巴細胞陰性,背景殘存的淋巴濾泡 B 淋巴細胞陽性(EnVision ×100);e. 間變性淋巴瘤激酶檢測顯示中等及中等偏大異型淋巴細胞陰性(EnVision ×200);f. CD2 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);g. CD3 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);h. CD5 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);i. CD7 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);j. CD30 檢測顯示中等及中等偏大異型淋巴細胞 15%~20% 陽性(EnVision ×200);k. Ki-67 檢測顯示中等及中等偏大異型淋巴細胞約 50% 陽性(EnVision ×200)。HE:蘇木精-伊紅染色;EnVision:EnVision 二步法染色
正電子發射計算機體層顯像示:① 全身多發淋巴結顯示、增大,氟脫氧葡萄糖(fluorodeoxyglucose, FDG)代謝增高;② 頭部、左側胸壁、腹盆部、腰背部、骶尾部、會陰部皮膚軟組織多發增厚,皮下脂肪間隙模糊,頭部、腰背部、骶尾部皮下及雙側睪丸鞘膜腔積液,皮膚病變 FDG 代謝增高(最大標準攝取值 7.36);③ 多個頸胸腰椎椎體附件、雙側肩胛骨髓腔內彌漫性 FDG 代謝稍增高,提示淋巴造血系統疾病可能性大。診斷為:MF,ⅣA2 期。
治療經過:2021 年 5 月 28 日患者開始干擾素聯合 CDOP 方案(環磷酰胺+鹽酸多柔比星脂質體+長春地辛+醋酸潑尼松)系統治療,同時采用藍光+外用糖皮質激素皮膚局部治療。患者局部皮膚紅腫、紅斑仍明顯,2021 年 6 月 18 日開始西達苯胺聯合 CDOP 方案化療,患者皮膚紅斑較前范圍擴大,充血腫脹較前加重,病情仍進行性進展。患者分別于 2021 年 7 月 8 日、2021 年 7 月 30 日開始維布妥昔單抗(brentuximab vedotin, BV)聯合 CDP 方案(環磷酰胺+鹽酸多柔比星脂質體+醋酸潑尼松)化療,2 個療程后皮損明顯減輕(圖4),但出現嚴重納差、全身皮膚痛覺過敏、不能下床活動,不能繼續耐受 BV+CDP 方案治療。進一步完善患者皮膚外周 T 細胞淋巴瘤(peripheral T-cell lymphoma, PTCL)熱點基因檢測,檢測出 LRP1B、PTPRD、REV3L、TET3 基因非同義突變(表1)。
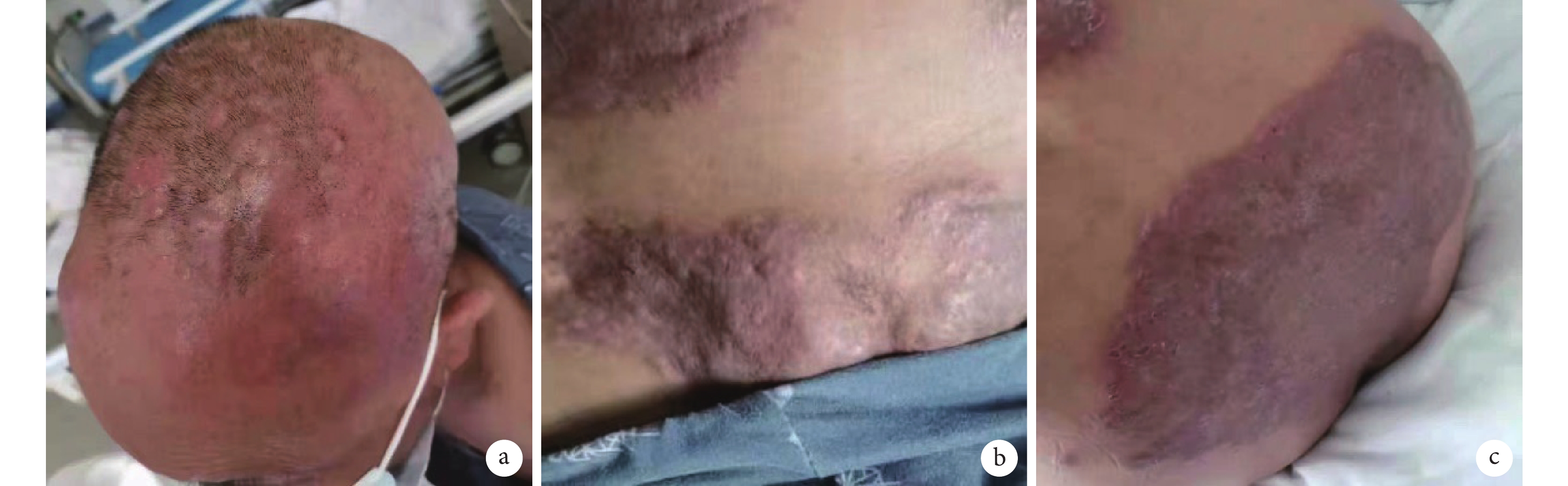
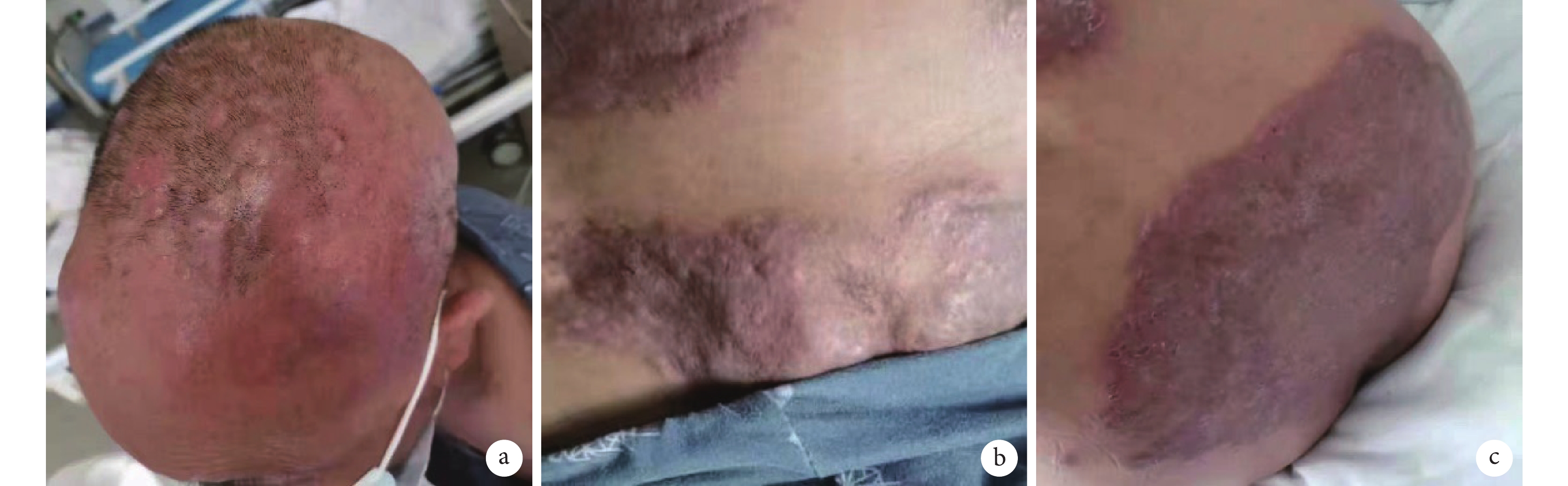 圖4
患者 BV+CDP 方案治療后皮損彩色像
圖4
患者 BV+CDP 方案治療后皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚呈暗紅色,團塊狀包塊較前縮小。BV+CDP 方案:維布妥昔單抗聯合環磷酰胺+鹽酸多柔比星脂質體+醋酸潑尼松
基于此,患者于 2021 年 8 月、9 月、11 月、12 月分別采用 PD-1 抗體信迪利單抗(Sintilimab)200 mg d0 聯合地西他濱 20 mg d1-3 治療,總計 4 個療程。治療過程中患者未出現發熱、惡心、嘔吐不適,食欲較前恢復,痛覺、過敏較前逐漸減輕,皮膚紅斑逐步消退(圖5);監測血常規、肝腎功能均未見異常。2022 年 1 月對患者再次行右側腰腹部皮膚活檢未見異常,評估病情為完全緩解。后因患方拒絕行自體造血干細胞移植,遂干擾素維持治療,直至 2022 年 5 月患者門診隨訪病情穩定。
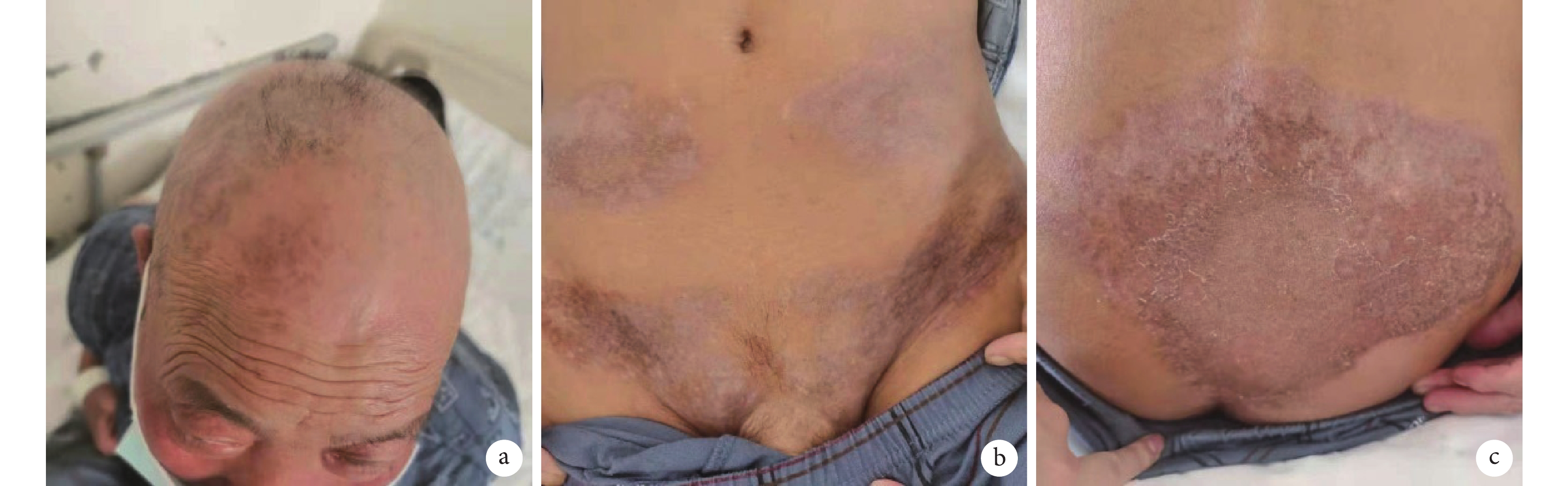 圖5
患者信迪利單抗聯合地西他濱治療后皮損彩色像
圖5
患者信迪利單抗聯合地西他濱治療后皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚紅斑已消退,可見褐色色素沉著,團塊狀皮損已消失,原頭部皮損處可見新生毛發長出
討論 MF 是 CTCL 中最常見一種亞型,占 CTCL 的 50%~70%[1]。該病目前病因未明,臨床表現多種多樣。MF 皮膚受累可分為不同的階段,從斑片期到斑塊期再到腫瘤期,都可能出現進展,也可能出現新的病變,早期通常預后良好,但進展期預后則很差。MF 沒有明確的標志物,因此診斷常常需要結合臨床表現、組織學表現、免疫表型及分子檢測進行綜合判斷。2005 年國際皮膚淋巴瘤協會推出了早期 MF 診斷評分系統,當臨床、組織病理、分子生物學和免疫組織病理學標準中任幾項積分之和≥4 分時,即可作出 MF 診斷。其中免疫表型若滿足“少于 50% 的 T 細胞表達 CD2、CD3 或 CD5”“少于 10% 的 T 細胞表達 CD7”“表皮細胞和真皮細胞在 CD2、CD3、CD5 或 CD7 的表達上存在差異”任意一項或以上可積 1 分[2]。而分子生物學 TCR 基因克隆性重排陽性積 1 分。MF 的分期采用了 TNMB 系統,該系統包括對皮膚(T)、淋巴結(N)、內臟器官(M)和血液(B)受累情況進行評估。根據臨床分期,ⅠA 期至Ⅱ期定義為早期 MF,ⅡB 期至ⅣB 期為晚期 MF。
MF 目前尚無法根治,疾病分期是選擇治療方法的主要根據。MF 早期以局部治療為主,包括局部藥物涂抹、光療法等,Ⅲ、Ⅳ期和難治性病變采用以全身治療為主的綜合治療[3-4]。當前針對 CTCL 的系統治療療效有限,尤其是對于晚期 MF 患者,通常的治療措施應答率低、病情改善維持時間短,且常伴有免疫抑制及其他嚴重的藥物相關副作用。近年來,一系列研究已經證實了 CTCL 存在多種分子參與[5-7],基因修飾中,最常見的是 DNMT3A、NCOR1、ARID1A 和 SETDB2 這 4 種腫瘤抑制基因[8-10]。地西他濱是甲基轉移酶抑制劑的代表性藥物之一,而小劑量地西他濱可以改變腫瘤和免疫細胞的表觀遺傳狀態,可增強 T 細胞活性[11-13]。遺傳和表觀遺傳改變都會影響抗腫瘤免疫反應[14-16]。其中 DNA 甲基化所造成的腫瘤抑制基因失活是腫瘤發生的重要機制之一。DNA 去甲基化程序促進 T 細胞耗盡和限制抗 PD-1 免疫治療,增強 PD-1 阻斷介導的 T 細胞信號[17-18]。從理論上講,地西他濱與 PD-1 抗體有協同作用[19-20]。此例患者病理組織(皮膚)采用高通量測序聯合生物信息學檢測方法,在 ALK、APC、IDH2 等 84 個 PTCL 相關基因中,檢測出 LRP1B、TET3 基因突變,目前 LRP1B 被認為是腫瘤抑制因子[21],TET3 基因突變引起的 DNA 去甲基化的缺陷,可能賦予腫瘤抑制基因的基因沉默[22]。地西他濱是一種核苷類似物,特異性作用于細胞分裂 S 期,其作用機制為磷酸化后的地西他濱參與 DNA 合成,然后與 DNA 甲基轉移酶共價結合并抑制其活性,從而造成 DNA 低甲基化,引起細胞分化或凋亡[23],從而發揮抗腫瘤作用。目前臨床上地西他濱主要用于治療骨髓增生異常綜合征,大劑量應用于患者易誘發嚴重的骨髓抑制作用,使用相對低劑量的地西他濱治療可使骨髓增生異常綜合征、慢性粒細胞白血病、急性髓系白血病等患者獲得較高的緩解率[24]。
目前國內外對應用地西他濱、PD-1 或程序性死亡配體 1(programmed death ligand-1, PD-L1)人單克隆抗體治療 MF 的安全性和有效性報道較少。由 Lesokhin 等[25]進行的Ⅰ期開放性研究納入 81 例復發難治的惡性血液腫瘤患者,包括 27 例多發性骨髓瘤、31 例 B 細胞淋巴瘤和 23 例 T 細胞淋巴瘤患者,其中 T 細胞淋巴瘤組包括 MF 13 例、PTCL 5 例、其他 T 細胞淋巴瘤 5 例,所有入組患者每 2 周給予 1 或 3 mg/kg 劑量的納武單抗,結果顯示濾泡性淋巴瘤、彌漫性大 B 細胞淋巴瘤、MF 和 PTCL 的客觀有效率分別為 40%、36%、15% 和 40%,且所有患者均顯示出良好的耐受性。Bar-Sela 等[26]報告了一例患有 MF 和黑色素瘤的 44 歲男性患者,經過 3 次易普利姆瑪單抗治療后,皮膚 MF 皮損全部消失,達到完全緩解。Sekulic 等[27]報告了一例 67 歲的ⅣA 期塞扎里綜合征老年女性患者,其先后接受光療、傳統化療等多種治療方法均無效,最終采用易普利姆瑪單抗單藥治療(3 mg/kg,每 3 周 1 次),早期取得了部分療效,無明顯毒性反應;給藥 10 d 后患者瘙癢癥狀減輕,皮膚紅斑范圍明顯縮小,基本恢復正常的生活活動;治療后第 6 周,盡管紅斑和活動耐量持續改善,患者頭部和頸部出現新的皮膚腫瘤,該患者在第 4 次用藥后病情迅速進展至死亡。Marchi 等[28]進行的一項Ⅰb 期研究(NCT03240211),主要評估免疫檢查點抑制劑聯合表觀遺傳修飾物是否有協同作用,該研究納入 12 例復發/難治性 PTCL 和 CTCL 患者接受帕博利珠單抗聯合普拉曲沙或地西他濱,或同時使用普拉曲沙和地西他濱治療,結果 1 例完全緩解、2 例部分緩解、1 例穩定、2 例進展;研究發現所有可評價療效的患者都采用的是普拉曲沙、地西他濱和帕博利珠單抗的三聯用藥。這些初步的臨床數據表明,在表觀遺傳學藥物基礎上聯合 PD-1/PD-L1 抗體是安全的,并在 PTCL 和 CTCL 患者中顯示出令人鼓舞的反應[29]。另一項由美國弗吉尼亞大學 Maria 等進行的Ⅰ/Ⅱa 期隨機開放研究(NCT03161223),主要目的是評估確定 5-阿扎胞苷和 PD-L1 抗體(度伐利尤單抗)、羅米地辛聯合用藥的最大耐受劑量、安全性和藥物毒性,結果發現這些藥物組合是可行的,并且研究正在進行中。
綜上所述,本例難治性 MF 患者通過地西他濱聯合 PD-1 抗體信迪利單抗治療結局是可喜的,但該例僅為個案,值得擴大規模開展臨床研究去進一步證實其有效性,同時其作用機制值得進一步研究。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,男,58 歲,主因“頸、腹、臀背部皮膚多處包塊 4 年,皮疹 5 個月”于 2021 年 5 月 26 日就診于四川大學華西醫院。2017 年患者無明顯誘因出現頸、腹、臀背部皮膚多處包塊,當地醫院按“皮疹”治療,病情進行性加重;2021 年 1 月患者皮膚包塊增多、增大,伴頭頸、胸背部、臀部散在紅色皮疹,局部皮膚破潰、滲液。患者既往無特殊病史。入院體格檢查:雙側頸部、腋窩、腹股溝區可捫及數枚腫大淋巴結,最大直徑約 2 cm,表面光滑、活動性好,質韌;頭頸部、腹部、臀背部彌漫分布紅色皮損(圖1),伴破潰、滲液;胸骨無壓痛,腹軟,肝脾肋下未觸及;雙下肢無水腫。實驗室檢查:白細胞計數 24.65×109/L,中性粒細胞計數 14.3×109/L,淋巴細胞計數 6.4×109/L,嗜酸性粒細胞計數 3.89×109/L,血紅蛋白 146 g/L,血小板計數 275×109/L,β2 微球蛋白 2.95 mg/L,乳酸脫氫酶 557 U/L,血清 EB 病毒 DNA 1.25×103 copies/mL。腹部皮膚活檢:表皮灶性壞死,余表皮部分角化不全棘層不規則增生,真皮全層小血管及皮膚附屬器周圍成片淋巴細胞、嗜酸性粒細胞、組織細胞及少量中性粒細胞浸潤,部分區域似有上皮樣肉芽腫形成,其中較多淋巴細胞較大、核形不規則;腹部皮膚活檢免疫組織化學檢測:CD3(+)、CD5(+)、CD45(+)、CD20(–)、CD68(–)、CD79α(–)、Ki-67(+,局灶高表達)、末端轉移酶(–)、CD56(–);結合形態學和免疫組織化學,患者腰腹部皮膚符合 T 細胞淋巴瘤(圖2)。頸部淋巴結活檢:淋巴結結構部分破壞,濾泡結構尚存在,濾泡間區見大細胞浸潤,細胞的細胞質豐富,呈嗜酸性,散在分布嗜酸性粒細胞;頸部淋巴結免疫組織化學檢測結果:大細胞 CD30(部分+,15%~20%)、CD2(+)、CD3(+)、CD5(+)、CD7(+)、上皮細胞膜抗原(+)、CD4(+)、Ki-67(+,50%)、CD21(–)、程序性死亡受體 1(programmed death 1, PD-1)(–)、CD20(–)、間變性淋巴瘤激酶(–)、P63(–)、CD15(–)、粒酶 B(–)、P53(+,10%),濾泡樹突狀細胞 CD21(+),病理學示成熟 T 細胞淋巴瘤;考慮原發皮膚 T 細胞淋巴瘤(cutaneous T cell lymphoma, CTCL)累及,蕈樣肉芽腫(mycosis fungoides, MF)可能性大(圖3)。骨髓細胞學:嗜酸性粒細胞增高占 17.5%。流式細胞學:淋巴細胞以異常 T 細胞為主(CD4+ CD25+)。
 圖1
患者治療前皮損彩色像
圖1
患者治療前皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚均可見呈團塊狀分布的淡紅色、暗紅色斑塊,其中臀部皮損表面可見少量鱗屑
 圖2
患者腹部皮膚活檢病理圖像
圖2
患者腹部皮膚活檢病理圖像
a. 腫瘤性淋巴細胞聚集成團(HE ×40); b. 腫瘤性淋巴細胞在纖維間質中呈浸潤性生長模式(HE ×100);c. 腫瘤性淋巴細胞小到中等大小,細胞核不規則,部分細胞質透明(HE ×200);d. 腫瘤性淋巴細胞細胞膜/質 CD3 陽性(EnVision ×100);e. 腫瘤性淋巴細胞細胞膜 CD5 陽性(EnVision ×100);f. 腫瘤性淋巴細胞細胞核 Ki-67 陽性(EnVision ×100)。HE:蘇木精-伊紅染色;EnVision:EnVision 二步法染色
 圖3
患者頸部淋巴結活檢病理圖像
圖3
患者頸部淋巴結活檢病理圖像
a. 淋巴結結構大部分破壞,中等及中等偏大異型淋巴細胞浸潤,可見殘存淋巴濾泡(HE ×40);b. 增生小血管周見中等及中等偏大異型淋巴細胞浸潤,背景散在嗜酸性粒細胞(HE ×200);c. 中等及中等偏大異型淋巴細胞,背景散在嗜酸性粒細胞(HE ×400);d. CD20 檢測顯示中等及中等偏大異型淋巴細胞陰性,背景殘存的淋巴濾泡 B 淋巴細胞陽性(EnVision ×100);e. 間變性淋巴瘤激酶檢測顯示中等及中等偏大異型淋巴細胞陰性(EnVision ×200);f. CD2 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);g. CD3 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);h. CD5 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);i. CD7 檢測顯示中等及中等偏大異型淋巴細胞陽性(EnVision ×200);j. CD30 檢測顯示中等及中等偏大異型淋巴細胞 15%~20% 陽性(EnVision ×200);k. Ki-67 檢測顯示中等及中等偏大異型淋巴細胞約 50% 陽性(EnVision ×200)。HE:蘇木精-伊紅染色;EnVision:EnVision 二步法染色
正電子發射計算機體層顯像示:① 全身多發淋巴結顯示、增大,氟脫氧葡萄糖(fluorodeoxyglucose, FDG)代謝增高;② 頭部、左側胸壁、腹盆部、腰背部、骶尾部、會陰部皮膚軟組織多發增厚,皮下脂肪間隙模糊,頭部、腰背部、骶尾部皮下及雙側睪丸鞘膜腔積液,皮膚病變 FDG 代謝增高(最大標準攝取值 7.36);③ 多個頸胸腰椎椎體附件、雙側肩胛骨髓腔內彌漫性 FDG 代謝稍增高,提示淋巴造血系統疾病可能性大。診斷為:MF,ⅣA2 期。
治療經過:2021 年 5 月 28 日患者開始干擾素聯合 CDOP 方案(環磷酰胺+鹽酸多柔比星脂質體+長春地辛+醋酸潑尼松)系統治療,同時采用藍光+外用糖皮質激素皮膚局部治療。患者局部皮膚紅腫、紅斑仍明顯,2021 年 6 月 18 日開始西達苯胺聯合 CDOP 方案化療,患者皮膚紅斑較前范圍擴大,充血腫脹較前加重,病情仍進行性進展。患者分別于 2021 年 7 月 8 日、2021 年 7 月 30 日開始維布妥昔單抗(brentuximab vedotin, BV)聯合 CDP 方案(環磷酰胺+鹽酸多柔比星脂質體+醋酸潑尼松)化療,2 個療程后皮損明顯減輕(圖4),但出現嚴重納差、全身皮膚痛覺過敏、不能下床活動,不能繼續耐受 BV+CDP 方案治療。進一步完善患者皮膚外周 T 細胞淋巴瘤(peripheral T-cell lymphoma, PTCL)熱點基因檢測,檢測出 LRP1B、PTPRD、REV3L、TET3 基因非同義突變(表1)。
 圖4
患者 BV+CDP 方案治療后皮損彩色像
圖4
患者 BV+CDP 方案治療后皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚呈暗紅色,團塊狀包塊較前縮小。BV+CDP 方案:維布妥昔單抗聯合環磷酰胺+鹽酸多柔比星脂質體+醋酸潑尼松
基于此,患者于 2021 年 8 月、9 月、11 月、12 月分別采用 PD-1 抗體信迪利單抗(Sintilimab)200 mg d0 聯合地西他濱 20 mg d1-3 治療,總計 4 個療程。治療過程中患者未出現發熱、惡心、嘔吐不適,食欲較前恢復,痛覺、過敏較前逐漸減輕,皮膚紅斑逐步消退(圖5);監測血常規、肝腎功能均未見異常。2022 年 1 月對患者再次行右側腰腹部皮膚活檢未見異常,評估病情為完全緩解。后因患方拒絕行自體造血干細胞移植,遂干擾素維持治療,直至 2022 年 5 月患者門診隨訪病情穩定。
 圖5
患者信迪利單抗聯合地西他濱治療后皮損彩色像
圖5
患者信迪利單抗聯合地西他濱治療后皮損彩色像
患者頭部(a)、腹部(b)、臀部(c)皮膚紅斑已消退,可見褐色色素沉著,團塊狀皮損已消失,原頭部皮損處可見新生毛發長出
討論 MF 是 CTCL 中最常見一種亞型,占 CTCL 的 50%~70%[1]。該病目前病因未明,臨床表現多種多樣。MF 皮膚受累可分為不同的階段,從斑片期到斑塊期再到腫瘤期,都可能出現進展,也可能出現新的病變,早期通常預后良好,但進展期預后則很差。MF 沒有明確的標志物,因此診斷常常需要結合臨床表現、組織學表現、免疫表型及分子檢測進行綜合判斷。2005 年國際皮膚淋巴瘤協會推出了早期 MF 診斷評分系統,當臨床、組織病理、分子生物學和免疫組織病理學標準中任幾項積分之和≥4 分時,即可作出 MF 診斷。其中免疫表型若滿足“少于 50% 的 T 細胞表達 CD2、CD3 或 CD5”“少于 10% 的 T 細胞表達 CD7”“表皮細胞和真皮細胞在 CD2、CD3、CD5 或 CD7 的表達上存在差異”任意一項或以上可積 1 分[2]。而分子生物學 TCR 基因克隆性重排陽性積 1 分。MF 的分期采用了 TNMB 系統,該系統包括對皮膚(T)、淋巴結(N)、內臟器官(M)和血液(B)受累情況進行評估。根據臨床分期,ⅠA 期至Ⅱ期定義為早期 MF,ⅡB 期至ⅣB 期為晚期 MF。
MF 目前尚無法根治,疾病分期是選擇治療方法的主要根據。MF 早期以局部治療為主,包括局部藥物涂抹、光療法等,Ⅲ、Ⅳ期和難治性病變采用以全身治療為主的綜合治療[3-4]。當前針對 CTCL 的系統治療療效有限,尤其是對于晚期 MF 患者,通常的治療措施應答率低、病情改善維持時間短,且常伴有免疫抑制及其他嚴重的藥物相關副作用。近年來,一系列研究已經證實了 CTCL 存在多種分子參與[5-7],基因修飾中,最常見的是 DNMT3A、NCOR1、ARID1A 和 SETDB2 這 4 種腫瘤抑制基因[8-10]。地西他濱是甲基轉移酶抑制劑的代表性藥物之一,而小劑量地西他濱可以改變腫瘤和免疫細胞的表觀遺傳狀態,可增強 T 細胞活性[11-13]。遺傳和表觀遺傳改變都會影響抗腫瘤免疫反應[14-16]。其中 DNA 甲基化所造成的腫瘤抑制基因失活是腫瘤發生的重要機制之一。DNA 去甲基化程序促進 T 細胞耗盡和限制抗 PD-1 免疫治療,增強 PD-1 阻斷介導的 T 細胞信號[17-18]。從理論上講,地西他濱與 PD-1 抗體有協同作用[19-20]。此例患者病理組織(皮膚)采用高通量測序聯合生物信息學檢測方法,在 ALK、APC、IDH2 等 84 個 PTCL 相關基因中,檢測出 LRP1B、TET3 基因突變,目前 LRP1B 被認為是腫瘤抑制因子[21],TET3 基因突變引起的 DNA 去甲基化的缺陷,可能賦予腫瘤抑制基因的基因沉默[22]。地西他濱是一種核苷類似物,特異性作用于細胞分裂 S 期,其作用機制為磷酸化后的地西他濱參與 DNA 合成,然后與 DNA 甲基轉移酶共價結合并抑制其活性,從而造成 DNA 低甲基化,引起細胞分化或凋亡[23],從而發揮抗腫瘤作用。目前臨床上地西他濱主要用于治療骨髓增生異常綜合征,大劑量應用于患者易誘發嚴重的骨髓抑制作用,使用相對低劑量的地西他濱治療可使骨髓增生異常綜合征、慢性粒細胞白血病、急性髓系白血病等患者獲得較高的緩解率[24]。
目前國內外對應用地西他濱、PD-1 或程序性死亡配體 1(programmed death ligand-1, PD-L1)人單克隆抗體治療 MF 的安全性和有效性報道較少。由 Lesokhin 等[25]進行的Ⅰ期開放性研究納入 81 例復發難治的惡性血液腫瘤患者,包括 27 例多發性骨髓瘤、31 例 B 細胞淋巴瘤和 23 例 T 細胞淋巴瘤患者,其中 T 細胞淋巴瘤組包括 MF 13 例、PTCL 5 例、其他 T 細胞淋巴瘤 5 例,所有入組患者每 2 周給予 1 或 3 mg/kg 劑量的納武單抗,結果顯示濾泡性淋巴瘤、彌漫性大 B 細胞淋巴瘤、MF 和 PTCL 的客觀有效率分別為 40%、36%、15% 和 40%,且所有患者均顯示出良好的耐受性。Bar-Sela 等[26]報告了一例患有 MF 和黑色素瘤的 44 歲男性患者,經過 3 次易普利姆瑪單抗治療后,皮膚 MF 皮損全部消失,達到完全緩解。Sekulic 等[27]報告了一例 67 歲的ⅣA 期塞扎里綜合征老年女性患者,其先后接受光療、傳統化療等多種治療方法均無效,最終采用易普利姆瑪單抗單藥治療(3 mg/kg,每 3 周 1 次),早期取得了部分療效,無明顯毒性反應;給藥 10 d 后患者瘙癢癥狀減輕,皮膚紅斑范圍明顯縮小,基本恢復正常的生活活動;治療后第 6 周,盡管紅斑和活動耐量持續改善,患者頭部和頸部出現新的皮膚腫瘤,該患者在第 4 次用藥后病情迅速進展至死亡。Marchi 等[28]進行的一項Ⅰb 期研究(NCT03240211),主要評估免疫檢查點抑制劑聯合表觀遺傳修飾物是否有協同作用,該研究納入 12 例復發/難治性 PTCL 和 CTCL 患者接受帕博利珠單抗聯合普拉曲沙或地西他濱,或同時使用普拉曲沙和地西他濱治療,結果 1 例完全緩解、2 例部分緩解、1 例穩定、2 例進展;研究發現所有可評價療效的患者都采用的是普拉曲沙、地西他濱和帕博利珠單抗的三聯用藥。這些初步的臨床數據表明,在表觀遺傳學藥物基礎上聯合 PD-1/PD-L1 抗體是安全的,并在 PTCL 和 CTCL 患者中顯示出令人鼓舞的反應[29]。另一項由美國弗吉尼亞大學 Maria 等進行的Ⅰ/Ⅱa 期隨機開放研究(NCT03161223),主要目的是評估確定 5-阿扎胞苷和 PD-L1 抗體(度伐利尤單抗)、羅米地辛聯合用藥的最大耐受劑量、安全性和藥物毒性,結果發現這些藥物組合是可行的,并且研究正在進行中。
綜上所述,本例難治性 MF 患者通過地西他濱聯合 PD-1 抗體信迪利單抗治療結局是可喜的,但該例僅為個案,值得擴大規模開展臨床研究去進一步證實其有效性,同時其作用機制值得進一步研究。
利益沖突:所有作者聲明不存在利益沖突。