經顱磁刺激(TMS)作為一種無創神經調控技術可以改善因疾病而造成的學習記憶損傷,而學習記憶調節依賴于突觸可塑性這一生理學基礎。TMS 可以影響大腦神經突觸可塑性,本文從結構和功能可塑性兩方面綜述其對突觸可塑性的影響;并進一步從突觸囊泡、神經遞質、突觸相關蛋白、腦源性神經營養因子及其相關通路揭示 TMS 作用機制。最后發現 TMS 通過對神經元形態、谷氨酸受體、神經遞質的影響,以及對腦源性神經營養因子表達的調節,從而調節突觸相關蛋白的表達,最終調節突觸結構和功能可塑性,從而影響學習記憶功能。本文綜述了 TMS 對學習記憶及大腦神經突觸可塑性的影響,期望對今后 TMS 作用機制的研究提供借鑒。
引用本文: 付蕊, 徐桂芝, 朱海軍, 丁沖. 經顱磁刺激對學習記憶及大腦神經突觸可塑性影響的研究進展. 生物醫學工程學雜志, 2021, 38(4): 783-789. doi: 10.7507/1001-5515.202010070 復制
引言
自 20 世紀 80 年代,經顱磁刺激(transcranial magnetic simulation,TMS)作為一種無創的神經調節技術,已被廣泛應用于抑郁癥、焦慮癥、阿爾茲海默病、帕金森病、血管性認知損害、孤獨癥譜系障礙、疼痛綜合征等臨床領域[1-7]。TMS 是電刺激的改良衍生物,是一項發展潛力無窮的神經電生理技術,其原理是在刺激線圈中產生一個強烈而非常短暫的電流脈沖,從而產生脈沖磁場,利用感應原理將電流通過頭皮、顱骨和腦膜等電阻層傳輸到大腦中,改變神經元的電環境,誘導皮層興奮性的變化。在足夠的刺激強度下向主運動皮層施加單個磁脈沖可激發對側目標肌肉中的運動誘發電位(motor evoked potential,MEP),MEP 能客觀反映中樞神經運動的傳導通路的連接,從而提供皮質脊髓傳導的功能評估[8]。重復性經顱磁刺激(repetitive transcranial magnetic stimulation,rTMS)的出現擴大了磁刺激的應用范圍,它通過不同頻率刺激使大腦皮層產生興奮或抑制,從而影響大腦某些皮質區的功能,展現出獨特的臨床和研究價值。
學習賦予了動物和人類更快速適應環境的能力,而記憶賦予了生物體的個性與多樣性;學習和記憶能力對于動物和人類是不可或缺的。人類對于學習和記憶的探索從未停止,近年來更是涌現出一系列調節學習記憶功能的方法。對于阿爾茲海默病以及腦卒中后遺癥等神經類疾病帶來的學習記憶功能損傷的調節更是很多人關注的問題。TMS 可以調節學習記憶,臨床上也大量將 TMS 和傳統康復手段結合來治療因某些神經類疾病帶來的學習記憶功能的損傷。據國外研究者報道,對一名右半球大腦中動脈區腦梗死后出現記憶力、注意力和執行功能障礙的 68 歲男性患者,在其左側背外側額葉皮質和左側后頂葉皮質進行持續 12 d 的低頻(1 Hz)rTMS,同時進行強化認知康復訓練。結果發現,其認知水平得到明顯改善[9]。更有大量研究者利用各種動物模型來研究 TMS 調節學習記憶的生理學內在機制。
學習記憶的調節依賴于突觸可塑性這一生理學基礎。突觸在神經信號的傳遞中發揮重要作用。神經科學之父——西班牙科學家卡哈爾通過顯微觀察發現神經細胞的形態結構不同于其他組織細胞,它存在不規則的突起(即樹突和軸突)。由此,他提出一個猜測:神經細胞通過接觸而非連通的突觸傳遞信息,前一個細胞的軸突是信號輸出,后一個細胞的樹突是信號接收。突觸可塑性是描述突觸連接強度在神經活動過程中的可調節性,即突觸結構和傳遞效能的改變。結構改變包括形態結構(包括突觸小泡數量、樹突棘數目等)的改變、新連接形成、新突觸成熟等;傳遞效能改變即突觸間傳遞效率提高或者抑制,包括長時程增強(long-term potentiation,LTP)和長時程抑制(long-term depression,LTD)[10]。基于這些基礎理論研究的發展,人們認為 TMS 可對大腦產生持續作用,其作用效果與突觸可塑性的變化有關[11]。
1 經顱磁刺激對神經突觸可塑性的影響
TMS 通過改變突觸可塑性來改善生物學習記憶功能,本章從 TMS 對突觸結構可塑性和功能可塑性兩方面論述其對突觸可塑性的改變。
1.1 經顱磁刺激對結構可塑性的影響
本節將從突觸形態以及樹突棘兩個方面的變化論述 TMS 對突觸結構可塑性的影響。
TMS 對神經突觸與細胞器形態影響的研究已有很多,Wang 等[12]利用刺激頻率為 5 Hz、刺激強度 0.5 T 的 rTMS 和間充質干細胞(mesenchymal stem cells,MSCs)移植相結合的方式來研究二者對血管性癡呆(vascular dementia,VD)大鼠的治療作用。通過手術方式構造大鼠 VD 模型,實驗共分 6 組,分別是對照組、假手術組、VD 組、MSCs 組、rTMS 組和 MSCs+rTMS 組。rTMS 治療需 6 個療程,每療程 5 d,療程兩兩間隔 2 d,脈沖數為 200 個/d。在電子顯微鏡下觀察發現,VD 組海馬角 1 區(cornu ammonis 1,CA1)的突觸呈不規則形狀、突觸前區域明顯變形、線粒體凝結、突觸后區域的體積減少、突觸前和突觸后膜增厚、突觸間隙消失。而在其他組中,突觸形態比 VD 組更規則、突觸數量增加,表明突觸損傷得以修復。在 MSCs+rTMS 組中突觸裂痕明顯,突觸后致密物(postsynaptic density,PSD)厚度、突觸活性區長度和突觸曲率都有所增加、線粒體聚集程度明顯降低。結果表明,MSCs 移植和 rTMS 的聯合治療對受損突觸有明顯恢復作用。馬雋[13]在 Swiss 小鼠海馬神經元體外培養實驗中,對神經元施加 1 Hz,強度分別為 1.14 T、1.52 T 持續 5 d 的磁刺激,結果發現磁刺激使神經元樹突和軸突的長度增加,并在體外建立更為緊密的神經網絡,但高強度刺激下神經元有細胞損傷、突起斷裂的現象;且磁刺激不能影響突觸間隙的寬度和突觸活性區的長度,但可使突觸密度和 PSD 厚度有所增加,在高強度刺激下會有突觸輪廓不清晰的現象。結果提示,較低強度磁刺激可促進突觸密度和活性的提升,高強度刺激會對突觸結構產生一定損傷。他還利用不同刺激強度的 1 Hz 磁刺激對新生昆明小鼠原代神經元進行處理,分為三個刺激強度(0.76、1.14、1.52 T),脈沖數為 300 個/d,持續 5 d。發現 0.76 T 強度組神經元突起長度增長且胞間神經聯系增多;1.14 T 強度組突起長度與數量增加且交織成密集的網絡;1.52 T 強度組突起數目增多且長度增加,但有細胞損傷現象[14]。由此猜測磁刺激通過影響神經元形態,在調控突觸結構可塑性中發揮重要作用。這兩個研究為以后刺激強度的選擇提供了一定的參考。Ma 等[15]利用 15 月齡昆明小鼠研究 5 Hz 的 rTMS 對老齡小鼠的影響,發現 PSD 厚度增加,突觸間隙寬度增加。Zuo 等[16]發現 5 Hz 和 25 Hz 的高頻 rTMS 可有效抑制慢性不可預知輕度應激所致抑郁小鼠的神經元丟失和凋亡。Cambiaghi 等[17]研究發現,利用 1 Hz 的 rTMS 處理抑郁小鼠,可誘導成熟顆粒細胞的結構可塑性,樹突狀長度和交叉點數目增加,樹突狀復雜度增加,最終明顯改善小鼠抑郁樣行為。Zhao 等[18]發現用 10 Hz 的 100% 靜息運動閾值(resting motor threshold,RMT)強度磁刺激治療因慢性不可預知輕度應激所致抑郁大鼠,可以恢復其神經元形態。刺激組海馬神經元數量較多,形態正常,細胞邊界清晰,排列有序。與此相反,抑郁組海馬神經元數量較少,細胞形態不規則,有萎縮退化,排列紊亂。Li 等[19]也發現對正常大鼠施加 0.5 Hz 的 rTMS,透射電鏡分析海馬 CA1 區突觸超微結構,發現與假手術組相比,刺激組突觸密度增加。Baek 等[20]建立缺氧/復氧后損傷的神經元模型,施加 10 Hz 高頻重復磁刺激可減少缺氧/復氧損傷后細胞凋亡。以上報道提示,rTMS 可通過影響突觸連接、神經元形態、突觸間隙以及細胞凋亡等影響突觸的結構可塑性。
樹突棘是樹突上的棘狀突起,其功能和形態可塑性是突觸發育和神經通路重塑的先決條件,是學習記憶的結構基礎[21]。Xiang 等[22]使用 15 Hz 的 rTMS 治療因尾吊(hindlimb unloading,HU)造成的 6 周雄性 C57BL/6 小鼠的認知損傷,采用高爾基—柯克斯染色測量海馬齒狀回(dentate gyrus,DG)和 CA1 區樹突棘密度,發現 rTMS 可有效阻止由 HU 誘導的樹突棘密度的降低。Zhai 等[23]也在 HU 小鼠中觀測到海馬 DG 區顆粒細胞的樹突棘密度在 rTMS 后升高,且學習記憶得到明顯改善。說明 rTMS 可以通過調節樹突棘密度來調節生物的突觸結構可塑性,從而影響生物的認知功能。
1.2 經顱磁刺激對功能可塑性的影響
不少研究表明 rTMS 可通過誘導 LTP 和 LTD 來改變突觸的功能可塑性,進而改善認知功能。興奮性突觸后電位(excitatory postsynaptic potential,EPSP)是興奮性的神經遞質與突觸后膜受體結合,引起突觸后膜去極化從而產生的電位,是突觸后膜產生興奮的表現。而通過記錄場興奮性突觸后電位(field excitatory postsynaptic potential,fEPSP),研究其斜率等變化是觀測 LTP 變化的重要指標。Zhai 等[23]記錄 1 h 的海馬穿通通路(perforant path,PP)到 DG 區的 fEPSP,并用最后穩定 10 min 的 fEPSP 斜率評估 LTP,發現 rTMS 可以改善 HU 小鼠的 LTP,且小鼠接觸新物體所花費時間百分比與 LTP 呈正相關。Xiang 等[22]通過對 fEPSP 的記錄和分析,發現 15 Hz 刺激可有效阻止 HU 小鼠 LTP 的損傷。提示 rTMS 預處理在預防微重力引起突觸可塑性缺陷中起到神經保護作用。在研究 rTMS 對因產前應激(prenatal stress,PNS)而造成子代認知損傷的實驗中,Shang 等[24]使用 30 d 雄性 Wistar 大鼠子代認知損傷模型,施加 5 Hz、120% RMT 強度的磁刺激,刺激脈沖數為 400 個/d,一共 14 d;結果 rTMS 明顯改善了大鼠受損的空間學習與記憶能力,且 fEPSP 平均斜率增加。結果提示 rTMS 可通過恢復 LTP 來改善突觸可塑性的損傷。Shang 等[25]研究 5 Hz 高頻 rTMS 對正常 Wistar 大鼠空間學習記憶和逆向記憶的影響,發現 fEPSP 斜率上升,rTMS 有效促進 LTP 的形成,從而增強大鼠空間認知能力。通過以上報道,證明 rTMS 可增強突觸功能可塑性,從而預防或改善因 HU、PNS 等疾病造成的突觸功能的損傷。
2 經顱磁刺激對神經突觸可塑性影響的機制研究
rTMS 對突觸可塑性的影響有結構和功能可塑性兩種,rTMS 是以什么機制影響到突觸可塑性的呢?下文將從突觸囊泡、神經遞質的釋放、突觸相關蛋白、腦源性神經營養因子(brain derived neurotrophic factor,BDNF)及其相關通路揭示其作用機制。
2.1 經顱磁刺激對囊泡的影響
在突觸前,突觸囊泡與突觸前膜結合,釋放神經遞質,神經遞質與突觸后膜的特異性蛋白結合,在下一個神經元產生興奮或抑制。所以突觸囊泡會在一定程度上影響到突觸可塑性。Wang 等[12]通過電子顯微鏡發現 VD 組海馬 CA1 區突觸小泡體積減少,而 MSCs+rTMS 組突觸前囊泡分布均勻。說明 rTMS 或可通過調節突觸前區域的囊泡來影響突觸結構可塑性。
2.2 經顱磁刺激對神經遞質的影響
神經遞質在化學突觸傳遞中不可或缺,谷氨酸、γ-氨基丁酸(γ-aminobutyric acid,GABA)、甘氨酸(glycine,Gly)和乙酰膽堿(acetylcholine,Ach)都是中樞神經系統中常見的神經遞質。TMS 會對神經遞質的釋放產生影響,Xiang 等[22]發現經 rTMS 后 HU 小鼠神經遞質釋放增加。
谷氨酸是重要的興奮性神經遞質,在認知損傷和神經退行性疾病模型小鼠中檢測到谷氨酸能神經傳遞障礙。GABA 和 Gly 是腦內主要的抑制性神經遞質。Ikeda 等[26]的研究表明,經 20 Hz 的 rTMS 干預后,小鼠小腦與腦干中谷氨酸、GABA 及 Gly 等神經遞質信使核糖核酸(messenger ribonucleic acid,mRNA)表達水平發生改變,提示 rTMS 可通過調節谷氨酸、GABA 和 Gly 等神經遞質水平調節神經元興奮性和突觸功能可塑性。
膽堿能神經元在興奮時合成并從神經末梢釋放 Ach,Ach 是一種興奮性神經遞質,且在學習記憶中起到重要作用。Zhang 等[27]利用雙血管阻斷法建立 VD 模型,然后對大鼠施加刺激頻率為 0.5 Hz,刺激強度為 1.33 T,脈沖數為 300 個/d 的 rTMS,刺激持續 4 周。發現 rTMS 可提高乙酰膽堿酯酶和膽堿乙酰轉移酶的活性,增加膽堿能神經元的密度。猜測 rTMS 改善 VD 大鼠學習記憶,其機制可能與海馬 CA1 區膽堿能系統活性恢復有關。故而本文猜測 rTMS 會影響神經遞質的釋放而影響突觸的功能可塑性。
2.3 經顱磁刺激對突觸相關蛋白的影響
突觸素(synaptophysin,SYN)與生長相關蛋白 43(growth-associated protein 43,GAP43)主要位于突觸前膜上,參與神經發育、反映突觸結構功能變化,SYN 是突觸囊泡的一種特異標志性膜蛋白,且在突觸的形成及突觸聯系建立、重建過程中發揮重要作用。生長相關蛋白(growth-associated protein,GAP)在新突觸連接形成及神經發育階段含量增加;且伴隨著軸突的生長,GAP 也呈現高表達;GAP43 是伴隨著突觸連接重建出現的。SYN 和 GAP43 常被作為突觸前特異性標志物來檢測突觸活力。PSD 見于突觸后膜,是在電鏡下可見的突觸后膜胞質面上聚集的一層均勻而致密的電子結構,積極參與調節神經遞質的分泌、積聚;樹突棘形成所需蛋白也要在 PSD 中合成,PSD 是中樞突觸結構可塑性的重要指標,與學習記憶能力密切相關。PSD 包含 5 類蛋白,分別是細胞骨架蛋白、神經遞質受體、信號酶、細胞黏附蛋白和銜接分子。PSD 中很多蛋白都參與突觸可塑性的調節[28]。PSD-95 是 PSD 中重要構成物質,通過與 N-甲基-D-天冬氨酸受體(N-methyl-D-aspartic acid receptor,NMDAR)亞基的 C 末端結合調節細胞蛋白表達和酶的活性,參與興奮性突觸的可塑性調節。
SYN、GAP、PSD 作為突觸特異性蛋白,可以反映突觸活性、形態變化及生物學功能[29]。Zhai 等[23]發現 rTMS 上調了 HU 小鼠 PSD-95 的表達。Xiang 等[22]發現經 rTMS 后 HU 小鼠突觸前蛋白(突觸小泡蛋白)和 PSD-95 表達增加。Shang 等[25]發現 rTMS 能通過增加突觸蛋白(synaptic proteins,SYP)的表達增強大鼠突觸可塑性。馬雋[13]利用細胞熒光免疫化學、蛋白質印跡(western blotting,WB)半定量分析及反轉錄聚合酶鏈式反應(reverse transcription-polymerase chain reaction,RT-PCR)技術檢測神經元胞體中 SYN、GAP43 以及 PSD-95 免疫陽性產物的表達部位,確定其細胞表達情況及三種蛋白表達和轉錄水平。免疫熒光結果顯示低強度磁刺激可以上調 SYN 免疫陽性產物的表達;在低強度和高強度刺激后 GAP43 和 PSD-95 免疫陽性產物的表達均有升高。WB 和 RT-PCR 結果顯示,磁刺激可以上調三種蛋白表達水平和轉錄水平;但高強度刺激下 SYN、PSD-95 兩種蛋白表達低于低強度組。結果提示,低強度磁刺激能夠促進突觸蛋白的合成,利于神經元的生長發育;高強度磁刺激會造成神經元及突觸的損傷,也許還伴隨有突觸結構重建、神經元修復的發生。SYN 也許是磁刺激誘導突觸結構變化的關鍵因素;而 GAP43 和 PSD-95 也可在損傷后的神經保護中起到神經代償性修復作用。在新生昆明小鼠原代神經元中,馬雋等[14]發現 0.76 T 組 SYN 免疫反應性及蛋白表達、SYN 和 GAP43 mRNA 表達量均增加;1.14 T 強度組 SYN 和 GAP43 免疫反應性、蛋白及 mRNA 表達量均增高;1.52 T 強度組 GAP43 免疫反應性有所升高,而 SYN 和 GAP43 mRNA 表達有所增加,因此猜測磁刺激通過上調 SYN 和 GAP43 的表達從而在調控突觸可塑性中發揮作用。Ma 等[15]和 Zuo 等[16]也發現經 rTMS 的老齡模型以及抑郁模型小鼠中 SYP 和 PSD-95 表達增加。Li 等[19]發現 rTMS 處理組 SYN 轉錄水平增加。Baek 等[20]發現高頻重復磁刺激可上調缺氧/復氧損傷后細胞 SYP 和 PSD-95 表達。SYN、GAP、PSD 等突觸結構蛋白的變化,主要改善突觸的結構可塑性,但突觸功能和突觸結構密不可分,所以 rTMS 是在影響 SYN、GAP、PSD 等突觸結構可塑性的同時進一步影響了突觸的功能可塑性。
上文提到 rTMS 在一定程度上調節 SYN、GAP、PSD 三種蛋白的轉錄及表達水平。對于其他影響突觸可塑性的蛋白、通路以及突觸后膜神經遞質受體,rTMS 也有一定的干預效果。
NMDAR 通道是谷氨酸能系統的重要執行和整合要素。該受體在神經回路的正常運作中起至關重要的作用,在神經系統發育(如調節神經元的存活、樹突與軸突的結構發育)中發揮重要作用,還會參與調節突觸可塑性,也是學習記憶過程中重要的受體。其功能低下或過度激活會導致神經元紊亂、產生神經毒性。NMDAR 由 3 類亞基構成:N-甲基-D-天冬氨酸受體 1(N-methyl-D-aspartic acid receptor 1,NR1)、N-甲基-D-天冬氨酸受體 2A~D 亞基(N-methyl-D-aspartic acid receptor 2A~D,NR2A~D)以及 N-甲基-D-天冬氨酸受體 3A~B 亞基(N-methyl-D-aspartic acid receptor 3A~B,NR3A~B)。其中 NR2B 對 LTP 和 LTD 至關重要,它決定突觸后的變化[30-31];可對學習記憶產生增強作用,或通過介導興奮性谷氨酸毒性作用導致神經功能損傷[32]。Baek 等[20]發現高頻重復磁刺激可增加缺氧/復氧損傷后細胞 NR1 蛋白表達水平。Wang 等[12]發現在 MSCs+rTMS 組 VD 大鼠中海馬 CA1 區 NR1 蛋白和 mRNA 水平升高。Zhai 等[23]發現 rTMS 增強了 HU 小鼠突觸后功能相關蛋白 NR2A 和 NR2B 的表達。Shang 等[24]發現 PNS 子代大鼠經 rTMS 后 NR2B 表達增加。Xiang 等[22]發現經 rTMS 后 HU 小鼠 NR2B 表達水平上調。Shang 等[25]發現 rTMS 通過增強海馬 CA1 區 NR2B mRNA 及蛋白表達,增強突觸傳遞效能。Zuo 等[16]發現經磁刺激后抑郁模型小鼠海馬區 NR2A 和 NR2B 蛋白表達增加。α-氨基-3 羥基-5 甲基-4 異惡唑受體(α-amino-3-hydroxy-5-methyl-4-is-oxazole-propionicacid receptor,AMPAR)是一種谷氨酸受體,它可以介導興奮性突觸傳遞,與 LTP 及 LTD 的誘發和維持有關,參與調節學習記憶過程。AMPAR 由 4 類亞基構成:谷氨酸受體 1~4(glutamate receptor,GluR1~4)。Liu 等[33]發現對創傷后應激障礙大鼠施加 15 Hz 的 rTMS,可以逆轉前扣帶皮層谷氨酸受體的損傷,NR1、NR2A、NR2B 以及 GluR1、GluR2、GluR3 和 GluR4 蛋白表達增加。如表 1 所示,通過以上報道可以看出,rTMS 通過影響突觸后膜上谷氨酸的兩種受體來調控突觸可塑性,且因突觸后膜的受體蛋白主要與 LTD 和 LTP 的誘發有關,故而猜測其主要影響了突觸的功能可塑性。
2.4 經顱磁刺激對 BDNF 及 BDNF-TrkB 信號通路的影響
BDNF 主要分布于哺乳動物海馬及皮層,以海馬角 3 區(cornu ammonis 3,CA3)最為豐富。對神經元的生長、存活、分化以及再生還有突觸可塑性都很重要。有研究表明,過高、過低的 BDNF 會打破腦中抑制性、興奮性神經傳遞之間的平衡,對 LTP 及學習記憶產生負面作用,且過高的 BDNF 更易刺激抑制性通路,從而損害 LTP 與記憶。但正常含量的 BDNF 對學習記憶有促進作用。BDNF 在學習記憶和突觸可塑性之間起橋梁作用。神經營養酪氨酸激酶受體 2(neurotrophic tyrosibe kinase receptor type 2,TrkB)是 BDNF 的特異性受體。TrkB 對海馬棘突的維持非常重要,去除 TrkB 后會使海馬 CA1 區錐體神經元的棘突密度大大下降。BDNF 與 TrkB 結合,在細胞生存、軸突生長以及調節突觸可塑性方面發揮重要作用[34]。
Wang 等[12]發現在 MSCs+rTMS 組 VD 大鼠中海馬 CA1 區 BDNF 表達水平升高且 mRNA 水平增加。Zhang 等[27]在 VD 大鼠的實驗中發現 rTMS 可明顯改善學習記憶且增加 BDNF 免疫反應細胞數。提示 rTMS 可通過促進海馬 CA1 區 BDNF 的表達來可改善 VD 大鼠的學習記憶障礙。Ma 等[15]發現 rTMS 可以提高老齡小鼠 BDNF 蛋白表達。Baek 等[20]發現高頻重復磁刺激可增加缺氧/復氧損傷后細胞 BDNF 蛋白表達水平。Xiang 等[22]發現經 rTMS 后 HU 小鼠 TrkB 表達上調。Zhai 等[23]在 HU 小鼠中發現,rTMS 處理后 BDNF 和 TrkB 表達水平增加。Zuo 等[16]亦發現經 rTMS 的抑郁模型小鼠海馬和前額皮層 BDNF 和 TrkB 蛋白表達增加。Cui 等[35]利用 10 Hz 的 rTMS 聯合有氧運動治療永久性大腦中動脈閉塞大鼠,發現 BDNF 和 TrkB 蛋白表達水平增加。Shang 等[24]發現 PNS 子代大鼠經 rTMS 后 BDNF-TrkB 信號通路得到改善。Shang 等[25]發現 rTMS 可增強海馬 CA1 區 BDNF mRNA 及蛋白表達。馬雋等[13-14]在 TMS 對神經元培養中發現,磁刺激后 BDNF 免疫反應性、蛋白及 mRNA 表達量均有升高;對 BDNF-TrkB 通路研究發現 TMS 上調 BDNF 和 TrkB 表達水平。Peng 等[36]也發現在 rTMS 聯合人神經干細胞移植治療中動脈閉塞大鼠后,可激活 BDNF/TrkB 信號通路。Shang 等[24]使用抑制劑使 BDNF-TrkB 通路抑制后施加 rTMS,發現小鼠 SYN、NR2A、NR2B 蛋白表達減少,突觸功能受損。所以本文猜測 BDNF-TrkB 是 rTMS 突觸結構可塑性的一個機制之一,因為影響了突觸的結構可塑性,進而影響了突觸的功能可塑性,如表 2 所示。
3 總結
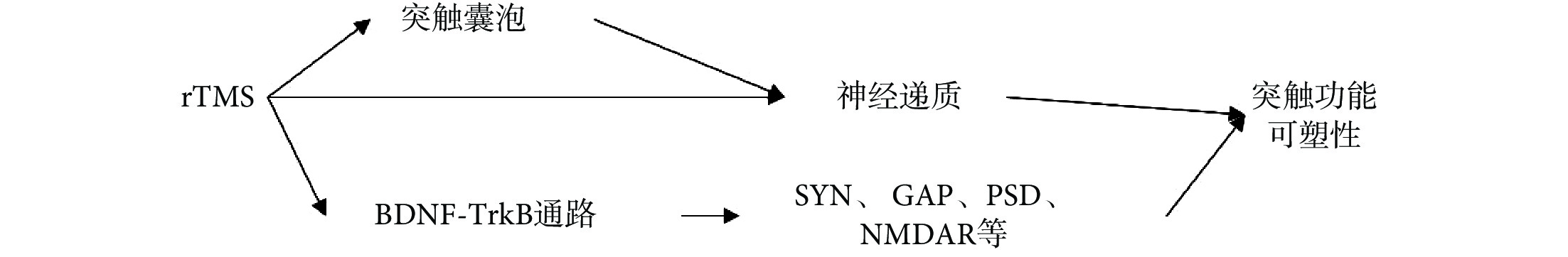
合適頻率和強度的 rTMS 可通過對神經元形態、谷氨酸受體、神經遞質的影響,以及對大腦中 BDNF 及 TrkB 等蛋白的表達的調節,從而調節 SYN、GAP43 和 PSD-95 等突觸蛋白的表達,最終調節突觸結構和功能可塑性,以此影響生物體的認知與學習記憶功能,達到疾病治療和康復的目的,如圖 1 所示。
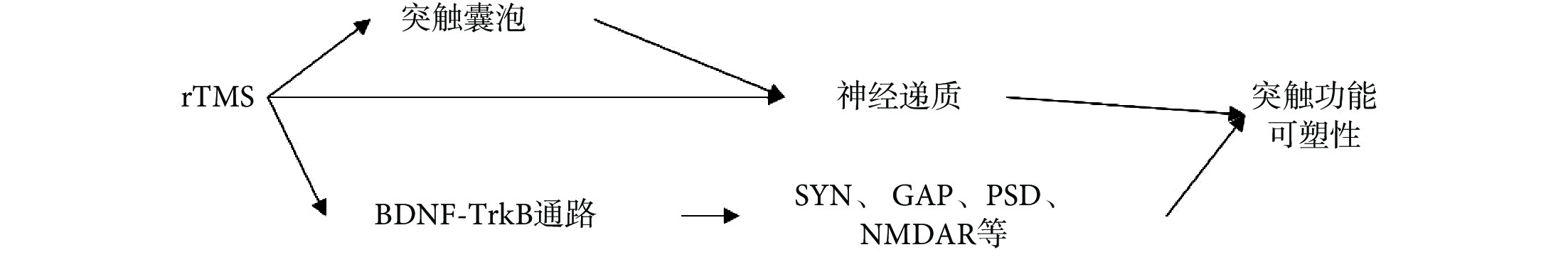 圖1
rTMS 影響突觸可塑性的相關機制
Figure1.
Mechanism of rTMS affecting synaptic plasticity
圖1
rTMS 影響突觸可塑性的相關機制
Figure1.
Mechanism of rTMS affecting synaptic plasticity
目前對 rTMS 改善學習記憶及突觸可塑性開展了大量研究,但仍有幾點有待完善:①rTMS 參數眾多,包括強度、頻率、刺激時長、刺激脈沖數等,現在并無統一定論,有待進一步研究其作用效果及針對不同病癥應做出哪些相應的調整。② 突觸可塑性與樹突的興奮性關系密切,研究可關注于 rTMS 是否影響神經元樹突的興奮性而影響突觸的可塑性。③ 新突觸的形成屬于突觸結構可塑性,以后的研究可關注新生神經元及新生突觸的發生與功能。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
自 20 世紀 80 年代,經顱磁刺激(transcranial magnetic simulation,TMS)作為一種無創的神經調節技術,已被廣泛應用于抑郁癥、焦慮癥、阿爾茲海默病、帕金森病、血管性認知損害、孤獨癥譜系障礙、疼痛綜合征等臨床領域[1-7]。TMS 是電刺激的改良衍生物,是一項發展潛力無窮的神經電生理技術,其原理是在刺激線圈中產生一個強烈而非常短暫的電流脈沖,從而產生脈沖磁場,利用感應原理將電流通過頭皮、顱骨和腦膜等電阻層傳輸到大腦中,改變神經元的電環境,誘導皮層興奮性的變化。在足夠的刺激強度下向主運動皮層施加單個磁脈沖可激發對側目標肌肉中的運動誘發電位(motor evoked potential,MEP),MEP 能客觀反映中樞神經運動的傳導通路的連接,從而提供皮質脊髓傳導的功能評估[8]。重復性經顱磁刺激(repetitive transcranial magnetic stimulation,rTMS)的出現擴大了磁刺激的應用范圍,它通過不同頻率刺激使大腦皮層產生興奮或抑制,從而影響大腦某些皮質區的功能,展現出獨特的臨床和研究價值。
學習賦予了動物和人類更快速適應環境的能力,而記憶賦予了生物體的個性與多樣性;學習和記憶能力對于動物和人類是不可或缺的。人類對于學習和記憶的探索從未停止,近年來更是涌現出一系列調節學習記憶功能的方法。對于阿爾茲海默病以及腦卒中后遺癥等神經類疾病帶來的學習記憶功能損傷的調節更是很多人關注的問題。TMS 可以調節學習記憶,臨床上也大量將 TMS 和傳統康復手段結合來治療因某些神經類疾病帶來的學習記憶功能的損傷。據國外研究者報道,對一名右半球大腦中動脈區腦梗死后出現記憶力、注意力和執行功能障礙的 68 歲男性患者,在其左側背外側額葉皮質和左側后頂葉皮質進行持續 12 d 的低頻(1 Hz)rTMS,同時進行強化認知康復訓練。結果發現,其認知水平得到明顯改善[9]。更有大量研究者利用各種動物模型來研究 TMS 調節學習記憶的生理學內在機制。
學習記憶的調節依賴于突觸可塑性這一生理學基礎。突觸在神經信號的傳遞中發揮重要作用。神經科學之父——西班牙科學家卡哈爾通過顯微觀察發現神經細胞的形態結構不同于其他組織細胞,它存在不規則的突起(即樹突和軸突)。由此,他提出一個猜測:神經細胞通過接觸而非連通的突觸傳遞信息,前一個細胞的軸突是信號輸出,后一個細胞的樹突是信號接收。突觸可塑性是描述突觸連接強度在神經活動過程中的可調節性,即突觸結構和傳遞效能的改變。結構改變包括形態結構(包括突觸小泡數量、樹突棘數目等)的改變、新連接形成、新突觸成熟等;傳遞效能改變即突觸間傳遞效率提高或者抑制,包括長時程增強(long-term potentiation,LTP)和長時程抑制(long-term depression,LTD)[10]。基于這些基礎理論研究的發展,人們認為 TMS 可對大腦產生持續作用,其作用效果與突觸可塑性的變化有關[11]。
1 經顱磁刺激對神經突觸可塑性的影響
TMS 通過改變突觸可塑性來改善生物學習記憶功能,本章從 TMS 對突觸結構可塑性和功能可塑性兩方面論述其對突觸可塑性的改變。
1.1 經顱磁刺激對結構可塑性的影響
本節將從突觸形態以及樹突棘兩個方面的變化論述 TMS 對突觸結構可塑性的影響。
TMS 對神經突觸與細胞器形態影響的研究已有很多,Wang 等[12]利用刺激頻率為 5 Hz、刺激強度 0.5 T 的 rTMS 和間充質干細胞(mesenchymal stem cells,MSCs)移植相結合的方式來研究二者對血管性癡呆(vascular dementia,VD)大鼠的治療作用。通過手術方式構造大鼠 VD 模型,實驗共分 6 組,分別是對照組、假手術組、VD 組、MSCs 組、rTMS 組和 MSCs+rTMS 組。rTMS 治療需 6 個療程,每療程 5 d,療程兩兩間隔 2 d,脈沖數為 200 個/d。在電子顯微鏡下觀察發現,VD 組海馬角 1 區(cornu ammonis 1,CA1)的突觸呈不規則形狀、突觸前區域明顯變形、線粒體凝結、突觸后區域的體積減少、突觸前和突觸后膜增厚、突觸間隙消失。而在其他組中,突觸形態比 VD 組更規則、突觸數量增加,表明突觸損傷得以修復。在 MSCs+rTMS 組中突觸裂痕明顯,突觸后致密物(postsynaptic density,PSD)厚度、突觸活性區長度和突觸曲率都有所增加、線粒體聚集程度明顯降低。結果表明,MSCs 移植和 rTMS 的聯合治療對受損突觸有明顯恢復作用。馬雋[13]在 Swiss 小鼠海馬神經元體外培養實驗中,對神經元施加 1 Hz,強度分別為 1.14 T、1.52 T 持續 5 d 的磁刺激,結果發現磁刺激使神經元樹突和軸突的長度增加,并在體外建立更為緊密的神經網絡,但高強度刺激下神經元有細胞損傷、突起斷裂的現象;且磁刺激不能影響突觸間隙的寬度和突觸活性區的長度,但可使突觸密度和 PSD 厚度有所增加,在高強度刺激下會有突觸輪廓不清晰的現象。結果提示,較低強度磁刺激可促進突觸密度和活性的提升,高強度刺激會對突觸結構產生一定損傷。他還利用不同刺激強度的 1 Hz 磁刺激對新生昆明小鼠原代神經元進行處理,分為三個刺激強度(0.76、1.14、1.52 T),脈沖數為 300 個/d,持續 5 d。發現 0.76 T 強度組神經元突起長度增長且胞間神經聯系增多;1.14 T 強度組突起長度與數量增加且交織成密集的網絡;1.52 T 強度組突起數目增多且長度增加,但有細胞損傷現象[14]。由此猜測磁刺激通過影響神經元形態,在調控突觸結構可塑性中發揮重要作用。這兩個研究為以后刺激強度的選擇提供了一定的參考。Ma 等[15]利用 15 月齡昆明小鼠研究 5 Hz 的 rTMS 對老齡小鼠的影響,發現 PSD 厚度增加,突觸間隙寬度增加。Zuo 等[16]發現 5 Hz 和 25 Hz 的高頻 rTMS 可有效抑制慢性不可預知輕度應激所致抑郁小鼠的神經元丟失和凋亡。Cambiaghi 等[17]研究發現,利用 1 Hz 的 rTMS 處理抑郁小鼠,可誘導成熟顆粒細胞的結構可塑性,樹突狀長度和交叉點數目增加,樹突狀復雜度增加,最終明顯改善小鼠抑郁樣行為。Zhao 等[18]發現用 10 Hz 的 100% 靜息運動閾值(resting motor threshold,RMT)強度磁刺激治療因慢性不可預知輕度應激所致抑郁大鼠,可以恢復其神經元形態。刺激組海馬神經元數量較多,形態正常,細胞邊界清晰,排列有序。與此相反,抑郁組海馬神經元數量較少,細胞形態不規則,有萎縮退化,排列紊亂。Li 等[19]也發現對正常大鼠施加 0.5 Hz 的 rTMS,透射電鏡分析海馬 CA1 區突觸超微結構,發現與假手術組相比,刺激組突觸密度增加。Baek 等[20]建立缺氧/復氧后損傷的神經元模型,施加 10 Hz 高頻重復磁刺激可減少缺氧/復氧損傷后細胞凋亡。以上報道提示,rTMS 可通過影響突觸連接、神經元形態、突觸間隙以及細胞凋亡等影響突觸的結構可塑性。
樹突棘是樹突上的棘狀突起,其功能和形態可塑性是突觸發育和神經通路重塑的先決條件,是學習記憶的結構基礎[21]。Xiang 等[22]使用 15 Hz 的 rTMS 治療因尾吊(hindlimb unloading,HU)造成的 6 周雄性 C57BL/6 小鼠的認知損傷,采用高爾基—柯克斯染色測量海馬齒狀回(dentate gyrus,DG)和 CA1 區樹突棘密度,發現 rTMS 可有效阻止由 HU 誘導的樹突棘密度的降低。Zhai 等[23]也在 HU 小鼠中觀測到海馬 DG 區顆粒細胞的樹突棘密度在 rTMS 后升高,且學習記憶得到明顯改善。說明 rTMS 可以通過調節樹突棘密度來調節生物的突觸結構可塑性,從而影響生物的認知功能。
1.2 經顱磁刺激對功能可塑性的影響
不少研究表明 rTMS 可通過誘導 LTP 和 LTD 來改變突觸的功能可塑性,進而改善認知功能。興奮性突觸后電位(excitatory postsynaptic potential,EPSP)是興奮性的神經遞質與突觸后膜受體結合,引起突觸后膜去極化從而產生的電位,是突觸后膜產生興奮的表現。而通過記錄場興奮性突觸后電位(field excitatory postsynaptic potential,fEPSP),研究其斜率等變化是觀測 LTP 變化的重要指標。Zhai 等[23]記錄 1 h 的海馬穿通通路(perforant path,PP)到 DG 區的 fEPSP,并用最后穩定 10 min 的 fEPSP 斜率評估 LTP,發現 rTMS 可以改善 HU 小鼠的 LTP,且小鼠接觸新物體所花費時間百分比與 LTP 呈正相關。Xiang 等[22]通過對 fEPSP 的記錄和分析,發現 15 Hz 刺激可有效阻止 HU 小鼠 LTP 的損傷。提示 rTMS 預處理在預防微重力引起突觸可塑性缺陷中起到神經保護作用。在研究 rTMS 對因產前應激(prenatal stress,PNS)而造成子代認知損傷的實驗中,Shang 等[24]使用 30 d 雄性 Wistar 大鼠子代認知損傷模型,施加 5 Hz、120% RMT 強度的磁刺激,刺激脈沖數為 400 個/d,一共 14 d;結果 rTMS 明顯改善了大鼠受損的空間學習與記憶能力,且 fEPSP 平均斜率增加。結果提示 rTMS 可通過恢復 LTP 來改善突觸可塑性的損傷。Shang 等[25]研究 5 Hz 高頻 rTMS 對正常 Wistar 大鼠空間學習記憶和逆向記憶的影響,發現 fEPSP 斜率上升,rTMS 有效促進 LTP 的形成,從而增強大鼠空間認知能力。通過以上報道,證明 rTMS 可增強突觸功能可塑性,從而預防或改善因 HU、PNS 等疾病造成的突觸功能的損傷。
2 經顱磁刺激對神經突觸可塑性影響的機制研究
rTMS 對突觸可塑性的影響有結構和功能可塑性兩種,rTMS 是以什么機制影響到突觸可塑性的呢?下文將從突觸囊泡、神經遞質的釋放、突觸相關蛋白、腦源性神經營養因子(brain derived neurotrophic factor,BDNF)及其相關通路揭示其作用機制。
2.1 經顱磁刺激對囊泡的影響
在突觸前,突觸囊泡與突觸前膜結合,釋放神經遞質,神經遞質與突觸后膜的特異性蛋白結合,在下一個神經元產生興奮或抑制。所以突觸囊泡會在一定程度上影響到突觸可塑性。Wang 等[12]通過電子顯微鏡發現 VD 組海馬 CA1 區突觸小泡體積減少,而 MSCs+rTMS 組突觸前囊泡分布均勻。說明 rTMS 或可通過調節突觸前區域的囊泡來影響突觸結構可塑性。
2.2 經顱磁刺激對神經遞質的影響
神經遞質在化學突觸傳遞中不可或缺,谷氨酸、γ-氨基丁酸(γ-aminobutyric acid,GABA)、甘氨酸(glycine,Gly)和乙酰膽堿(acetylcholine,Ach)都是中樞神經系統中常見的神經遞質。TMS 會對神經遞質的釋放產生影響,Xiang 等[22]發現經 rTMS 后 HU 小鼠神經遞質釋放增加。
谷氨酸是重要的興奮性神經遞質,在認知損傷和神經退行性疾病模型小鼠中檢測到谷氨酸能神經傳遞障礙。GABA 和 Gly 是腦內主要的抑制性神經遞質。Ikeda 等[26]的研究表明,經 20 Hz 的 rTMS 干預后,小鼠小腦與腦干中谷氨酸、GABA 及 Gly 等神經遞質信使核糖核酸(messenger ribonucleic acid,mRNA)表達水平發生改變,提示 rTMS 可通過調節谷氨酸、GABA 和 Gly 等神經遞質水平調節神經元興奮性和突觸功能可塑性。
膽堿能神經元在興奮時合成并從神經末梢釋放 Ach,Ach 是一種興奮性神經遞質,且在學習記憶中起到重要作用。Zhang 等[27]利用雙血管阻斷法建立 VD 模型,然后對大鼠施加刺激頻率為 0.5 Hz,刺激強度為 1.33 T,脈沖數為 300 個/d 的 rTMS,刺激持續 4 周。發現 rTMS 可提高乙酰膽堿酯酶和膽堿乙酰轉移酶的活性,增加膽堿能神經元的密度。猜測 rTMS 改善 VD 大鼠學習記憶,其機制可能與海馬 CA1 區膽堿能系統活性恢復有關。故而本文猜測 rTMS 會影響神經遞質的釋放而影響突觸的功能可塑性。
2.3 經顱磁刺激對突觸相關蛋白的影響
突觸素(synaptophysin,SYN)與生長相關蛋白 43(growth-associated protein 43,GAP43)主要位于突觸前膜上,參與神經發育、反映突觸結構功能變化,SYN 是突觸囊泡的一種特異標志性膜蛋白,且在突觸的形成及突觸聯系建立、重建過程中發揮重要作用。生長相關蛋白(growth-associated protein,GAP)在新突觸連接形成及神經發育階段含量增加;且伴隨著軸突的生長,GAP 也呈現高表達;GAP43 是伴隨著突觸連接重建出現的。SYN 和 GAP43 常被作為突觸前特異性標志物來檢測突觸活力。PSD 見于突觸后膜,是在電鏡下可見的突觸后膜胞質面上聚集的一層均勻而致密的電子結構,積極參與調節神經遞質的分泌、積聚;樹突棘形成所需蛋白也要在 PSD 中合成,PSD 是中樞突觸結構可塑性的重要指標,與學習記憶能力密切相關。PSD 包含 5 類蛋白,分別是細胞骨架蛋白、神經遞質受體、信號酶、細胞黏附蛋白和銜接分子。PSD 中很多蛋白都參與突觸可塑性的調節[28]。PSD-95 是 PSD 中重要構成物質,通過與 N-甲基-D-天冬氨酸受體(N-methyl-D-aspartic acid receptor,NMDAR)亞基的 C 末端結合調節細胞蛋白表達和酶的活性,參與興奮性突觸的可塑性調節。
SYN、GAP、PSD 作為突觸特異性蛋白,可以反映突觸活性、形態變化及生物學功能[29]。Zhai 等[23]發現 rTMS 上調了 HU 小鼠 PSD-95 的表達。Xiang 等[22]發現經 rTMS 后 HU 小鼠突觸前蛋白(突觸小泡蛋白)和 PSD-95 表達增加。Shang 等[25]發現 rTMS 能通過增加突觸蛋白(synaptic proteins,SYP)的表達增強大鼠突觸可塑性。馬雋[13]利用細胞熒光免疫化學、蛋白質印跡(western blotting,WB)半定量分析及反轉錄聚合酶鏈式反應(reverse transcription-polymerase chain reaction,RT-PCR)技術檢測神經元胞體中 SYN、GAP43 以及 PSD-95 免疫陽性產物的表達部位,確定其細胞表達情況及三種蛋白表達和轉錄水平。免疫熒光結果顯示低強度磁刺激可以上調 SYN 免疫陽性產物的表達;在低強度和高強度刺激后 GAP43 和 PSD-95 免疫陽性產物的表達均有升高。WB 和 RT-PCR 結果顯示,磁刺激可以上調三種蛋白表達水平和轉錄水平;但高強度刺激下 SYN、PSD-95 兩種蛋白表達低于低強度組。結果提示,低強度磁刺激能夠促進突觸蛋白的合成,利于神經元的生長發育;高強度磁刺激會造成神經元及突觸的損傷,也許還伴隨有突觸結構重建、神經元修復的發生。SYN 也許是磁刺激誘導突觸結構變化的關鍵因素;而 GAP43 和 PSD-95 也可在損傷后的神經保護中起到神經代償性修復作用。在新生昆明小鼠原代神經元中,馬雋等[14]發現 0.76 T 組 SYN 免疫反應性及蛋白表達、SYN 和 GAP43 mRNA 表達量均增加;1.14 T 強度組 SYN 和 GAP43 免疫反應性、蛋白及 mRNA 表達量均增高;1.52 T 強度組 GAP43 免疫反應性有所升高,而 SYN 和 GAP43 mRNA 表達有所增加,因此猜測磁刺激通過上調 SYN 和 GAP43 的表達從而在調控突觸可塑性中發揮作用。Ma 等[15]和 Zuo 等[16]也發現經 rTMS 的老齡模型以及抑郁模型小鼠中 SYP 和 PSD-95 表達增加。Li 等[19]發現 rTMS 處理組 SYN 轉錄水平增加。Baek 等[20]發現高頻重復磁刺激可上調缺氧/復氧損傷后細胞 SYP 和 PSD-95 表達。SYN、GAP、PSD 等突觸結構蛋白的變化,主要改善突觸的結構可塑性,但突觸功能和突觸結構密不可分,所以 rTMS 是在影響 SYN、GAP、PSD 等突觸結構可塑性的同時進一步影響了突觸的功能可塑性。
上文提到 rTMS 在一定程度上調節 SYN、GAP、PSD 三種蛋白的轉錄及表達水平。對于其他影響突觸可塑性的蛋白、通路以及突觸后膜神經遞質受體,rTMS 也有一定的干預效果。
NMDAR 通道是谷氨酸能系統的重要執行和整合要素。該受體在神經回路的正常運作中起至關重要的作用,在神經系統發育(如調節神經元的存活、樹突與軸突的結構發育)中發揮重要作用,還會參與調節突觸可塑性,也是學習記憶過程中重要的受體。其功能低下或過度激活會導致神經元紊亂、產生神經毒性。NMDAR 由 3 類亞基構成:N-甲基-D-天冬氨酸受體 1(N-methyl-D-aspartic acid receptor 1,NR1)、N-甲基-D-天冬氨酸受體 2A~D 亞基(N-methyl-D-aspartic acid receptor 2A~D,NR2A~D)以及 N-甲基-D-天冬氨酸受體 3A~B 亞基(N-methyl-D-aspartic acid receptor 3A~B,NR3A~B)。其中 NR2B 對 LTP 和 LTD 至關重要,它決定突觸后的變化[30-31];可對學習記憶產生增強作用,或通過介導興奮性谷氨酸毒性作用導致神經功能損傷[32]。Baek 等[20]發現高頻重復磁刺激可增加缺氧/復氧損傷后細胞 NR1 蛋白表達水平。Wang 等[12]發現在 MSCs+rTMS 組 VD 大鼠中海馬 CA1 區 NR1 蛋白和 mRNA 水平升高。Zhai 等[23]發現 rTMS 增強了 HU 小鼠突觸后功能相關蛋白 NR2A 和 NR2B 的表達。Shang 等[24]發現 PNS 子代大鼠經 rTMS 后 NR2B 表達增加。Xiang 等[22]發現經 rTMS 后 HU 小鼠 NR2B 表達水平上調。Shang 等[25]發現 rTMS 通過增強海馬 CA1 區 NR2B mRNA 及蛋白表達,增強突觸傳遞效能。Zuo 等[16]發現經磁刺激后抑郁模型小鼠海馬區 NR2A 和 NR2B 蛋白表達增加。α-氨基-3 羥基-5 甲基-4 異惡唑受體(α-amino-3-hydroxy-5-methyl-4-is-oxazole-propionicacid receptor,AMPAR)是一種谷氨酸受體,它可以介導興奮性突觸傳遞,與 LTP 及 LTD 的誘發和維持有關,參與調節學習記憶過程。AMPAR 由 4 類亞基構成:谷氨酸受體 1~4(glutamate receptor,GluR1~4)。Liu 等[33]發現對創傷后應激障礙大鼠施加 15 Hz 的 rTMS,可以逆轉前扣帶皮層谷氨酸受體的損傷,NR1、NR2A、NR2B 以及 GluR1、GluR2、GluR3 和 GluR4 蛋白表達增加。如表 1 所示,通過以上報道可以看出,rTMS 通過影響突觸后膜上谷氨酸的兩種受體來調控突觸可塑性,且因突觸后膜的受體蛋白主要與 LTD 和 LTP 的誘發有關,故而猜測其主要影響了突觸的功能可塑性。
2.4 經顱磁刺激對 BDNF 及 BDNF-TrkB 信號通路的影響
BDNF 主要分布于哺乳動物海馬及皮層,以海馬角 3 區(cornu ammonis 3,CA3)最為豐富。對神經元的生長、存活、分化以及再生還有突觸可塑性都很重要。有研究表明,過高、過低的 BDNF 會打破腦中抑制性、興奮性神經傳遞之間的平衡,對 LTP 及學習記憶產生負面作用,且過高的 BDNF 更易刺激抑制性通路,從而損害 LTP 與記憶。但正常含量的 BDNF 對學習記憶有促進作用。BDNF 在學習記憶和突觸可塑性之間起橋梁作用。神經營養酪氨酸激酶受體 2(neurotrophic tyrosibe kinase receptor type 2,TrkB)是 BDNF 的特異性受體。TrkB 對海馬棘突的維持非常重要,去除 TrkB 后會使海馬 CA1 區錐體神經元的棘突密度大大下降。BDNF 與 TrkB 結合,在細胞生存、軸突生長以及調節突觸可塑性方面發揮重要作用[34]。
Wang 等[12]發現在 MSCs+rTMS 組 VD 大鼠中海馬 CA1 區 BDNF 表達水平升高且 mRNA 水平增加。Zhang 等[27]在 VD 大鼠的實驗中發現 rTMS 可明顯改善學習記憶且增加 BDNF 免疫反應細胞數。提示 rTMS 可通過促進海馬 CA1 區 BDNF 的表達來可改善 VD 大鼠的學習記憶障礙。Ma 等[15]發現 rTMS 可以提高老齡小鼠 BDNF 蛋白表達。Baek 等[20]發現高頻重復磁刺激可增加缺氧/復氧損傷后細胞 BDNF 蛋白表達水平。Xiang 等[22]發現經 rTMS 后 HU 小鼠 TrkB 表達上調。Zhai 等[23]在 HU 小鼠中發現,rTMS 處理后 BDNF 和 TrkB 表達水平增加。Zuo 等[16]亦發現經 rTMS 的抑郁模型小鼠海馬和前額皮層 BDNF 和 TrkB 蛋白表達增加。Cui 等[35]利用 10 Hz 的 rTMS 聯合有氧運動治療永久性大腦中動脈閉塞大鼠,發現 BDNF 和 TrkB 蛋白表達水平增加。Shang 等[24]發現 PNS 子代大鼠經 rTMS 后 BDNF-TrkB 信號通路得到改善。Shang 等[25]發現 rTMS 可增強海馬 CA1 區 BDNF mRNA 及蛋白表達。馬雋等[13-14]在 TMS 對神經元培養中發現,磁刺激后 BDNF 免疫反應性、蛋白及 mRNA 表達量均有升高;對 BDNF-TrkB 通路研究發現 TMS 上調 BDNF 和 TrkB 表達水平。Peng 等[36]也發現在 rTMS 聯合人神經干細胞移植治療中動脈閉塞大鼠后,可激活 BDNF/TrkB 信號通路。Shang 等[24]使用抑制劑使 BDNF-TrkB 通路抑制后施加 rTMS,發現小鼠 SYN、NR2A、NR2B 蛋白表達減少,突觸功能受損。所以本文猜測 BDNF-TrkB 是 rTMS 突觸結構可塑性的一個機制之一,因為影響了突觸的結構可塑性,進而影響了突觸的功能可塑性,如表 2 所示。
3 總結
合適頻率和強度的 rTMS 可通過對神經元形態、谷氨酸受體、神經遞質的影響,以及對大腦中 BDNF 及 TrkB 等蛋白的表達的調節,從而調節 SYN、GAP43 和 PSD-95 等突觸蛋白的表達,最終調節突觸結構和功能可塑性,以此影響生物體的認知與學習記憶功能,達到疾病治療和康復的目的,如圖 1 所示。
 圖1
rTMS 影響突觸可塑性的相關機制
Figure1.
Mechanism of rTMS affecting synaptic plasticity
圖1
rTMS 影響突觸可塑性的相關機制
Figure1.
Mechanism of rTMS affecting synaptic plasticity
目前對 rTMS 改善學習記憶及突觸可塑性開展了大量研究,但仍有幾點有待完善:①rTMS 參數眾多,包括強度、頻率、刺激時長、刺激脈沖數等,現在并無統一定論,有待進一步研究其作用效果及針對不同病癥應做出哪些相應的調整。② 突觸可塑性與樹突的興奮性關系密切,研究可關注于 rTMS 是否影響神經元樹突的興奮性而影響突觸的可塑性。③ 新突觸的形成屬于突觸結構可塑性,以后的研究可關注新生神經元及新生突觸的發生與功能。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。