人腦局部場電位記錄為探索腦深部核團功能提供了獨特的方法。本文為研究丘腦底核局部場電位的同步化和動態穩定特性以及藥物治療對其的影響,對帕金森病患者的丘腦底核局部場電位信號進行功率譜分析、時頻分析和幅度變異系數分析。結果表明,低Beta頻段在不服藥狀態下存在明顯的過度同步化,藥物治療可顯著抑制該成分。此外,服藥后Theta成分同步化特征顯著升高且動態波動性增強,同時Gamma頻段動態波動性亦顯著增加。丘腦底核局部場電位在藥物作用下多頻段同步化與穩定性發生變化,有可能與帕金森病藥物作用下異動等癥狀的發生有關。這些特征的發現將有助于為帕金森病的機制研究與藥物治療建立基于多特征融合的敏感和特異的神經標記物,為實現閉環深部腦刺激提供判別指標。
引用本文: 王亞楠, 耿馨佚, 黃永志, 王守巖. 丘腦底核神經波動同步化和穩定性特征與藥物治療相關*. 生物醫學工程學雜志, 2016, 33(1): 49-55. doi: 10.7507/1001-5515.20160010 復制
0 引言
帕金森病是一種常見的退行性神經系統疾病,其癥狀的產生與患者丘腦底核神經活動異常密切相關。通過深部腦刺激電極可直接記錄到的人腦深部局部場電位神經電活動,具有高時間和空間分辨率[1-3],蘊含豐富的生理、病理功能相關信息,為探索帕金森病發病及藥物治療機制提供了獨特的方法[4-5]。目前對帕金森病患者丘腦底核局部場電位的研究表明,其神經波動在Beta(12~30 Hz)頻段存在過度同步化現象[6-8],而多巴胺類藥物可以有效抑制這種異常的神經波動[9],且治療效果與神經活動被抑制程度有關。藥物對神經活動的影響亦是帕金森病其它臨床治療手段的基礎,如深部腦刺激必須與藥物相結合才能達到最佳的臨床治療效果。研究多巴胺類藥物對帕金森病患者丘腦底核神經波動的影響,將有助于建立基于多特征的神經標志物體系,用于探索藥物治療以及深部腦刺激作用的可能機制。
目前關于藥物對帕金森病患者丘腦底核局部場電位神經波動影響的研究主要集中于藥物對神經波動同步化特征的影響,如服藥后神經波動Beta頻段過度同步化被抑制,高Gamma頻段同步化增強[10-11]等。帕金森病患者丘腦底核神經波動除具有幅度增強同步化特征外,還具有動態時變特征,與癥狀相關的Beta頻段的峰值頻率和幅度都會隨時間變化[12],因而多巴胺類藥物對丘腦底核神經波動的影響亦應表現在多個方面。此外,帕金森病神經活動的同步化和動態穩定性特征還具有明顯的個體化特性,而與之相關的神經波動個體化特點在闡明疾病及其治療的共性機制,以及發展更為可靠的與疾病和治療相關的神經標志物方面,具有重要的作用。
本文針對丘腦底核局部場電位幅度的同步化和穩定性特征,使用功率譜分析方法定量多節律神經波動的幅度同步化特征,使用時頻分析以及各頻段時變幅度的變異系數定量分析神經波動的動態時變特性,分析信號幅度隨時間動態變化相對于信號平均幅度的穩定程度,進而研究藥物對各特征的影響。本文通過定量分析多巴胺類藥物對帕金森病患者丘腦底核局部場電位神經波動的影響,研究藥物對帕金森病患者腦功能狀態神經波動的調節模式,為尋找與帕金森病藥物治療相關的更為可靠的神經波動生物標記提供基礎,并為提取多特征融合的神經標記物奠定基礎。
1 方法
1.1 局部場電位記錄及數據預處理
被試者在英國牛津大學John Radcliffe Hospital完成丘腦底核深部腦刺激電極植入手術,術后3~5 d從留置的腦深部刺激電極記錄獲得受試者腦深部局部場電位。腦深部刺激電極型號為3389(美敦力公司,明尼蘇達,美國),電極有四個鉑-銥圓柱表面觸點(直徑1.27 mm,長度1.5 mm),觸點之間距離為0.5 mm。三通道局部場電位為從4個觸點雙極差分同步記錄所得(觸點0-1、1-2、2-3),公共電極放置于乳突。記錄過程中仔細固定電極連接導線以減少外界干擾與運動偽跡影響,電極植入后通過核磁共振成像對電極植入位置進行確認。
共采集17名帕金森病患者34側電極分別在服藥與不服藥時坐位靜息狀態下的局部場電位信號,其中5側信號記錄質量不佳,未在本研究中使用。記錄場電位的同時監測肌電信號,選擇25 s無震顫狀態下的信號進行后續分析以減小癥狀差異影響。患者停藥24 h后記錄不服藥狀態場電位信號,服藥后1.5 h藥效穩定時記錄服藥狀態場電位信號。信號經由CED 1902隔離放大器放大(Cambridge Electronic Design,UK),局部場電位放大10 000倍,帶通濾波參數為0.5~500 Hz,并使用CED1401 Ⅱ和Spike2軟件(Cambridge Electronic Design,UK)對信號進行模數轉換和采集,采樣頻率為2 000 Hz。實驗獲得當地道德倫理委員會批準許可,數據已得到英國牛津大學功能神經外科研究組授權使用。
信號預處理對信號進行90 Hz抗混疊低通濾波(切比雪夫Ⅰ型濾波器),信號統一降采樣至1 000 Hz,采用自適應迭代濾波器濾除50 Hz工頻干擾,最后進行3 Hz高通濾波去除低頻噪聲(切比雪夫Ⅰ型濾波器)。
1.2 功率譜分析
場電位信號各頻率成分的幅度分布使用平均功率譜分析方法進行計算,度量局部場電位信號各頻段的同步化特征。功率譜分析使用Welch算法,選用2 s的Hamming數據窗、數據窗重疊長度為1 s,快速傅里葉變換點數為2 048。 首先計算25 s局部場電位信號的功率譜密度,然后通過統計學分析在各頻率段比較服藥前后功率譜密度的變化,確定藥物對局部場電位信號同步化特征的顯著性影響。
1.3 時頻分析
短時傅里葉變換用于觀察局部場電位信號不同成分的幅度隨時間的變化情況[13]。本文使用短時傅里葉變換研究局部場電位信號的動態時變特性,窗長0.25 s,重疊0.2 s,快速傅里葉變換點數為2 048,時頻分析結果的時間分辨率為0.25 s,頻率分辨率約為4 Hz。
1.4 變異系數分析
變異系數(coefficient of variation,CV)指樣本標準差與平均值的百分比,反映信號相對波動程度。本文使用變異系數這一參數表示局部場電位信號各成分的穩定程度,變異系數隨數據長度增加而收斂,25 s場電位信號長度保證了該變量的計算可靠性。首先以1 Hz為單位在短時傅立葉變換的時頻譜中對頻率積分,得到在各頻率的信號幅度隨時間變化的曲線,然后計算各頻率下時變幅度的標準差和平均值,進而計算變異系數,得到變異系數頻率分布曲線。
1.5 統計分析
本文使用Wilcoxon秩檢驗對各指標在服藥前后進行統計學比較分析。Wilcoxon秩檢驗是非參數檢驗的一種,它對樣本總體分布沒有嚴格要求,且Wilcoxon秩檢驗通過計算樣本排序等級對差異性進行評估,避免了少數大幅度樣本的干擾。文中通過對服藥前后兩組數據進行Wilcoxon秩檢驗,確定在各頻段的功率譜密度或變異系數在服藥前后的差異是否具有統計學意義。
2 結果
2.1 同步化特征分析
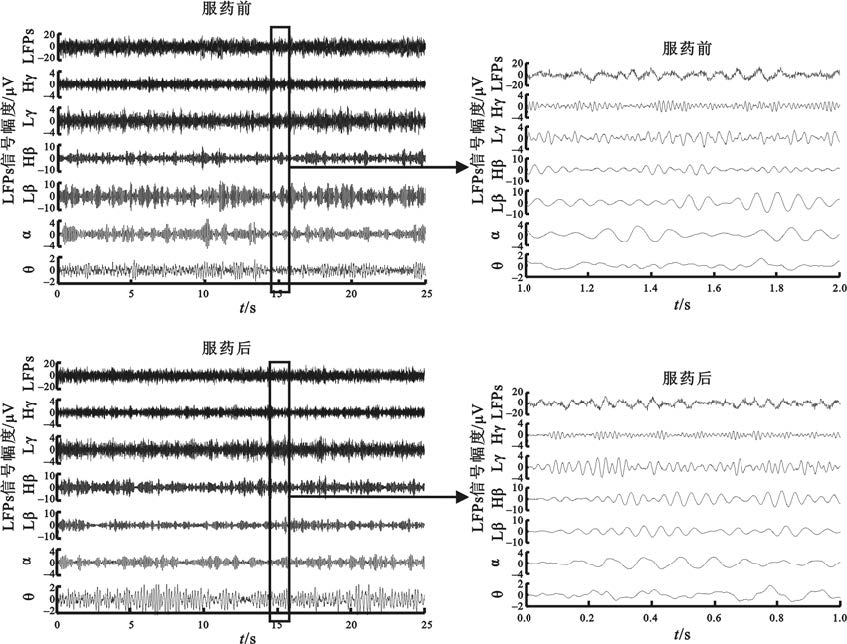
丘腦底核局部場電位具有多頻率成分,包含豐富的生理病理相關信息。其中,與帕金森病密切相關的頻段主要有Theta(4~7 Hz)、Alpha(8~12 Hz)、 Beta(13~30 Hz)和Gamma(30~90 Hz)等頻段,一些頻段還可細分為低Beta(13~20 Hz)、高Beta(20~30 Hz)、低Gamma(30~60 Hz)以及高Gamma(60~90 Hz)。藥物對局部場電位各頻段神經波動具有不同影響(圖1),場電位信號各頻率成分的幅度隨時間而起伏,服藥后場電位信號Beta成分幅度明顯下降。
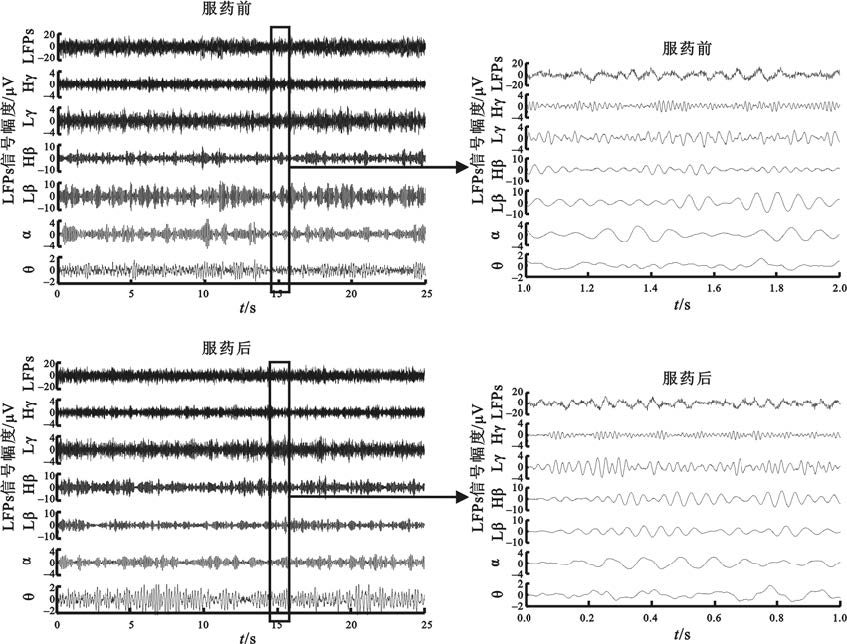 圖1
丘腦底核局部場電位原始信號及各頻段的濾波信號
圖1
丘腦底核局部場電位原始信號及各頻段的濾波信號
LFPs:局部場電位原始信號;Hγ:高Gamma頻段;Lγ:低Gamma頻段;Hβ:高Beta頻段;Lβ:低Beta頻段;α:Alpha頻段;θ:Theta頻段
Figure1. Original subthalamic local field potentials and components of each frequency bandLFPs: original local field potentials; Hγ: high gamma component; Lγ: low gamma component; H β: high beta component; Lβ : low beta component; α: alpha component; θ: theta component
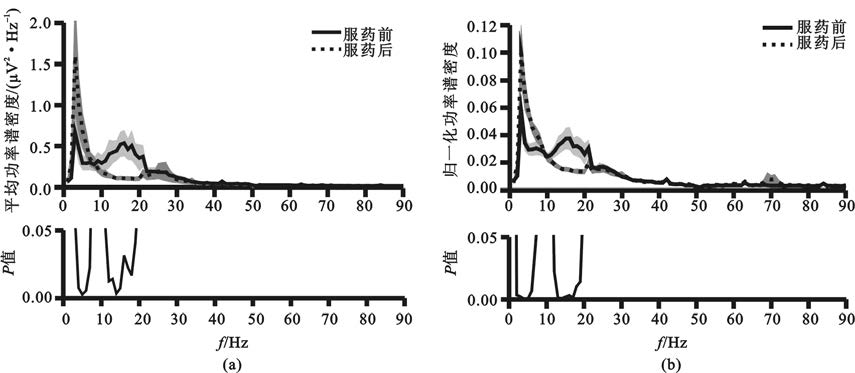
采用信號的功率譜分析可以對神經活動幅度的同步化特征進行定量分析,并通過比較服藥前后信號功率譜密度度量藥物對同步化特征的影響,同時使用Wilcoxon秩檢驗的方法檢驗服藥前后功率譜密度,確定受藥物顯著影響的頻段(圖2)。結果表明,在不服藥狀態下,神經活動具有低頻、低Beta、高Beta等明顯譜峰[圖2(a)];為減少記錄環境、記錄條件等外界因素的干擾,對功率譜密度進行積分得到各信號的總功率,以功率譜密度除以總功率對其進行歸一化處理,在歸一化譜上4~7 Hz、8~10 Hz、10~22 Hz、22~30 Hz等頻段更為明顯[圖2(b)]。多巴胺類藥物顯著抑制了13~20 Hz的低Beta成分的幅度,提高了4~7 Hz的Theta成分[P<0.05,圖2(a)]。在歸一化譜上進一步可見服藥后低Beta成分顯著降低,以及Theta成分顯著升高[P<0.05,圖2(b)],服藥后高Gamma頻段同步化有所增高,但差異未見統計學意義[圖2(b)]。
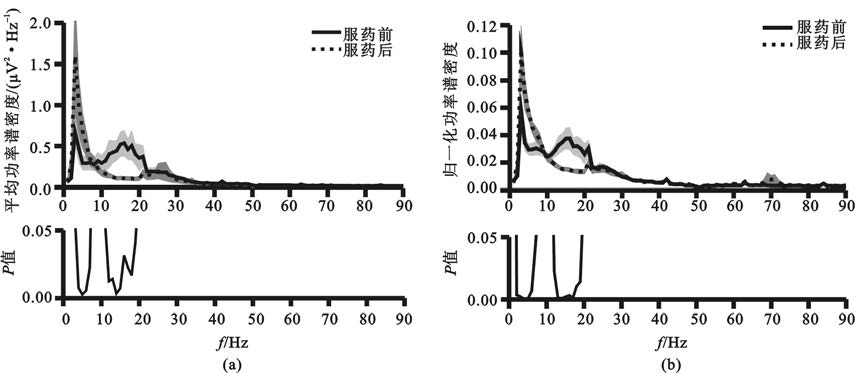 圖2
各頻率處局部場電位信號的功率譜密度均值以及服藥前后的統計學分析結果
圖2
各頻率處局部場電位信號的功率譜密度均值以及服藥前后的統計學分析結果
(a)功率譜絕對值的統計結果;(b)歸一化功率譜統計結果,其中陰影代表±標準差
Figure2. Average power spectra of subthalamic local field potentials at each frequency band and the statistical significance between the on- and off-medication states(a) results of absolute power spectra density; (b) results of normalized power spectra density,the shadow represents ±standard deviation
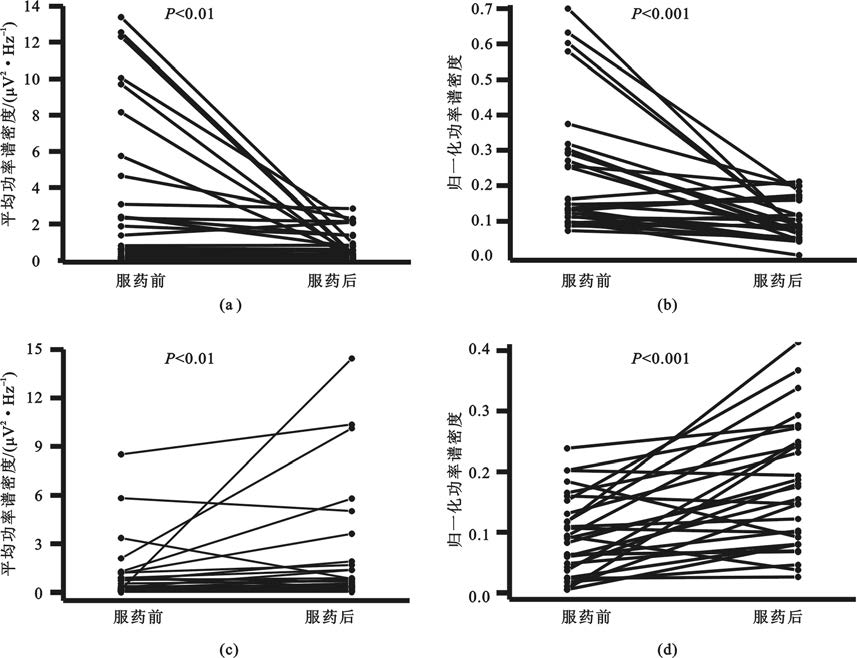
為進一步觀察低Beta和Theta頻段受藥物影響的同步化特征的個體化分布,計算了兩個頻段內的平均幅度并進行統計分析(圖3)。結果表明低Beta頻段信號幅度服藥后顯著降低[P<0.01,圖3(a)],Theta頻段幅度明顯升高[P<0.01,圖3(c)]。歸一化結果進一步證實低Beta和Theta頻段均發生顯著改變[P<0.001,圖3(b);P<0.001,圖3(d)]。在所有數據中Beta成分降低的比例為76%,Theta成分增高的比例為83%。
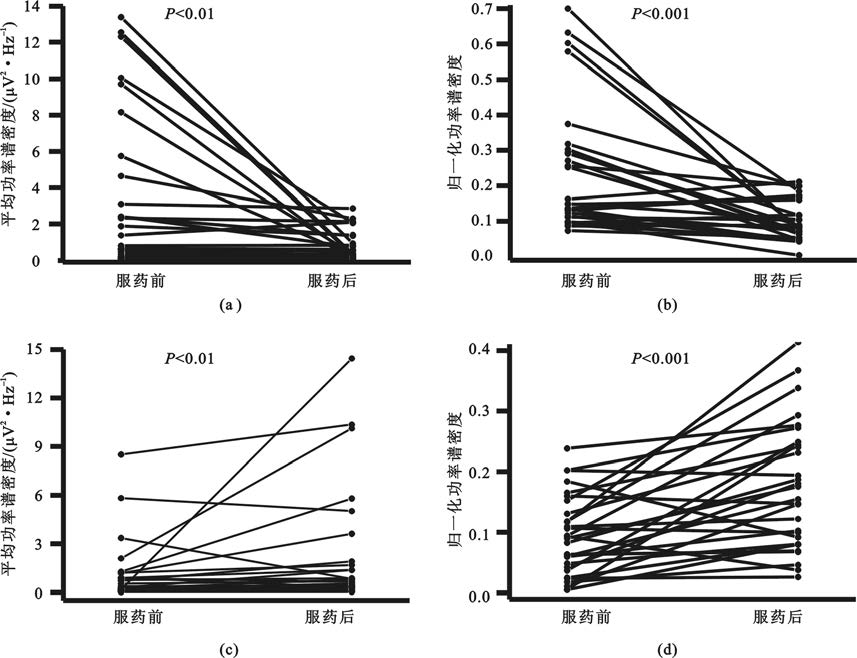 圖3
受藥物顯著影響頻段的能量變化情況
圖3
受藥物顯著影響頻段的能量變化情況
(a)低Beta同步化;(b)歸一化低Beta同步化;(c)Theta同步化;(d)歸一化Theta同步化
Figure3. Power change at frequency bands significantly affected bymedication(a) low beta synchronization; (b) normalized low beta synchronization; (c) theta band synchronization; (d) normalized theta band synchronization
2.2 動態時變特性分析
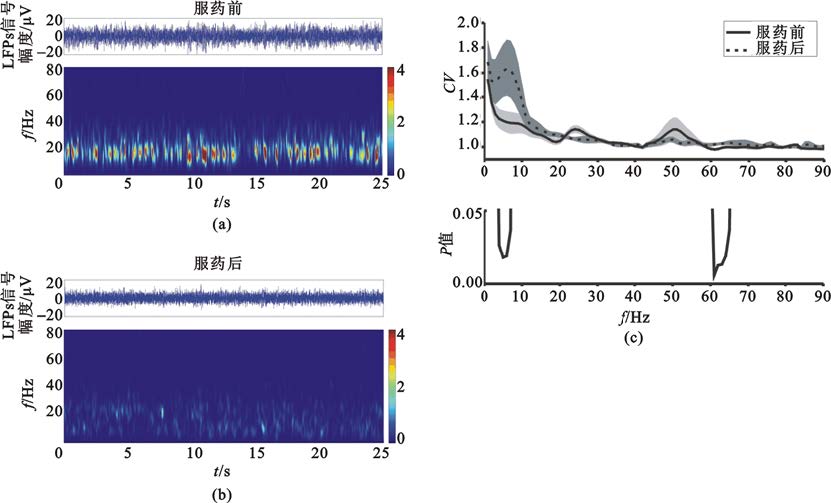
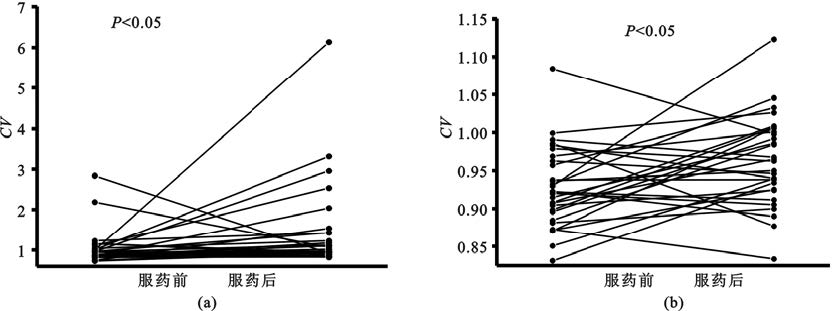
丘腦底核場電位的Theta和低Beta成分的幅度受藥物顯著影響,各神經波動成分具有動態時變特性[圖4(a)(b)],其動態穩定性亦受到藥物影響。本文使用時變幅度的變異系數來度量其動態穩定特性[圖4(c)]。服藥后0~90 Hz各神經活動成分的波動性有所改變,其中4~10 Hz、10~22 Hz、60~70 Hz頻段波動性升高,22~30 Hz、45~55 Hz頻段波動性降低。經統計學檢驗,4~7 Hz的Theta成分和60~66 Hz的Gamma成分具有顯著變化[P<0.05,圖4(c)]。為進一步觀察Theta成分和高Gamma成分受藥物影響的動態特征的個體化分布,計算了兩個頻段內的積分所得信號幅度的變異系數并進行統計分析。結果表明Theta成分和高Gamma成分的波動性均顯著升高(P<0.05,圖5)。在所有數據中Theta成分變異系數上升的比例為76%[圖5(a)],高Gamma成分變異系數上升的比例為69%[圖5(b)]。
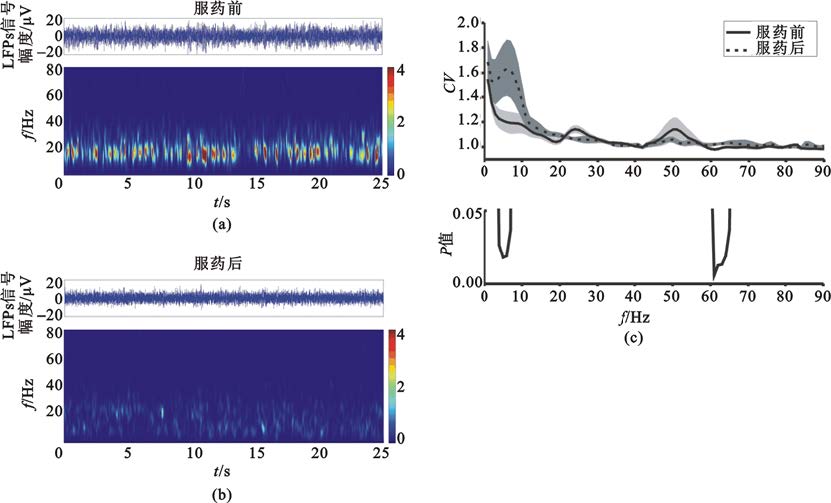 圖4
服藥前后各頻段局部場電位信號能量的穩定性
圖4
服藥前后各頻段局部場電位信號能量的穩定性
(a)(b)為服藥前后局部場電位信號的短時傅里葉變換;(c)為時變能量變異系數頻率分布曲線和服藥前后變異系數的統計學分析,其中陰影代表±標準差
Figure4. Dynamic characteristics of subthalamic local field potentials at each frequency band(a) (b) short-time Fourier transform of subthalamic local field potentials; (c) coefficient of variation of the time-variant power and the statistical significance,and the shadow represents ±standard deviation
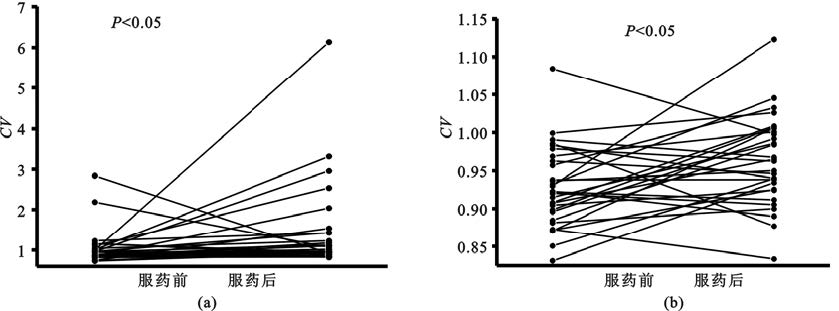 圖5
受藥物顯著影響頻段時變能量變異系數的變化情況
圖5
受藥物顯著影響頻段時變能量變異系數的變化情況
(a)Theta頻段;(b)高Gamma頻段
Figure5. Change of coefficients of variation of time-variant power at frequency bands significantly affected by medication(a) theta band; (b) high gamma band
3 討論與結論
神經核團活動具有多頻率神經波動成分,亦展現出同步化、動態性等特征[12]。以往的工作研究了其同步化特征,而本文則結合動態時變性、個體化等多方面信息,以期對丘腦底核功能提供更為全面的整體分析。
目前關于藥物對神經波動的影響研究主要集中在同步化特征上[11]。Alonso-Frech等[11]發現服藥后11~30 Hz頻段同步化被顯著抑制,而4~10 Hz和60~80 Hz頻段同步化升高。本文結果進一步證明僅13~20 Hz的低Beta成分降低與藥物影響密切相關,而20~30 Hz的高Beta成分則未見明顯改變,提示神經波動成分具有更為精細的功能區分,低、高Beta成分應具有不同的功能。
場電位信號的時頻分析結果表明丘腦底核神經波動具有顯著的時變特性。本文通過分析藥物對丘腦底核神經波動穩定性的影響,發現服藥后4~7 Hz和60~66 Hz頻段的波動性顯著升高。文獻報道4~7 Hz頻段的神經波動負責傳輸非自主運動信號到丘腦皮層運動區[14],本研究則說明藥物使得低頻神經活動同步化程度增高、穩定性降低,這有可能是藥物引起帕金森病異動癥狀的原因之一。此外,有研究發現Gamma頻段神經活動與運動反應時間[15]和認知[16]有關,本文發現服藥后該頻段的波動性提高,提示帕金森病患者用藥后運動反應以及認知能力提高可能與其有關。
帕金森病及其治療均與丘腦底核的神經活動密切相關,本文研究表明丘腦底核的幅度同步化程度以及幅度的穩定性均顯著受到藥物影響。一方面可將上述多個特征與臨床評價指標進行融合,形成與帕金森病治療相關的更為敏感和特異的神經生物標記物;另一方面這些指標亦可用于帕金森病患者的腦功能狀態判定,進而為帕金森病閉環深部腦刺激反饋算法提供判別依據。
0 引言
帕金森病是一種常見的退行性神經系統疾病,其癥狀的產生與患者丘腦底核神經活動異常密切相關。通過深部腦刺激電極可直接記錄到的人腦深部局部場電位神經電活動,具有高時間和空間分辨率[1-3],蘊含豐富的生理、病理功能相關信息,為探索帕金森病發病及藥物治療機制提供了獨特的方法[4-5]。目前對帕金森病患者丘腦底核局部場電位的研究表明,其神經波動在Beta(12~30 Hz)頻段存在過度同步化現象[6-8],而多巴胺類藥物可以有效抑制這種異常的神經波動[9],且治療效果與神經活動被抑制程度有關。藥物對神經活動的影響亦是帕金森病其它臨床治療手段的基礎,如深部腦刺激必須與藥物相結合才能達到最佳的臨床治療效果。研究多巴胺類藥物對帕金森病患者丘腦底核神經波動的影響,將有助于建立基于多特征的神經標志物體系,用于探索藥物治療以及深部腦刺激作用的可能機制。
目前關于藥物對帕金森病患者丘腦底核局部場電位神經波動影響的研究主要集中于藥物對神經波動同步化特征的影響,如服藥后神經波動Beta頻段過度同步化被抑制,高Gamma頻段同步化增強[10-11]等。帕金森病患者丘腦底核神經波動除具有幅度增強同步化特征外,還具有動態時變特征,與癥狀相關的Beta頻段的峰值頻率和幅度都會隨時間變化[12],因而多巴胺類藥物對丘腦底核神經波動的影響亦應表現在多個方面。此外,帕金森病神經活動的同步化和動態穩定性特征還具有明顯的個體化特性,而與之相關的神經波動個體化特點在闡明疾病及其治療的共性機制,以及發展更為可靠的與疾病和治療相關的神經標志物方面,具有重要的作用。
本文針對丘腦底核局部場電位幅度的同步化和穩定性特征,使用功率譜分析方法定量多節律神經波動的幅度同步化特征,使用時頻分析以及各頻段時變幅度的變異系數定量分析神經波動的動態時變特性,分析信號幅度隨時間動態變化相對于信號平均幅度的穩定程度,進而研究藥物對各特征的影響。本文通過定量分析多巴胺類藥物對帕金森病患者丘腦底核局部場電位神經波動的影響,研究藥物對帕金森病患者腦功能狀態神經波動的調節模式,為尋找與帕金森病藥物治療相關的更為可靠的神經波動生物標記提供基礎,并為提取多特征融合的神經標記物奠定基礎。
1 方法
1.1 局部場電位記錄及數據預處理
被試者在英國牛津大學John Radcliffe Hospital完成丘腦底核深部腦刺激電極植入手術,術后3~5 d從留置的腦深部刺激電極記錄獲得受試者腦深部局部場電位。腦深部刺激電極型號為3389(美敦力公司,明尼蘇達,美國),電極有四個鉑-銥圓柱表面觸點(直徑1.27 mm,長度1.5 mm),觸點之間距離為0.5 mm。三通道局部場電位為從4個觸點雙極差分同步記錄所得(觸點0-1、1-2、2-3),公共電極放置于乳突。記錄過程中仔細固定電極連接導線以減少外界干擾與運動偽跡影響,電極植入后通過核磁共振成像對電極植入位置進行確認。
共采集17名帕金森病患者34側電極分別在服藥與不服藥時坐位靜息狀態下的局部場電位信號,其中5側信號記錄質量不佳,未在本研究中使用。記錄場電位的同時監測肌電信號,選擇25 s無震顫狀態下的信號進行后續分析以減小癥狀差異影響。患者停藥24 h后記錄不服藥狀態場電位信號,服藥后1.5 h藥效穩定時記錄服藥狀態場電位信號。信號經由CED 1902隔離放大器放大(Cambridge Electronic Design,UK),局部場電位放大10 000倍,帶通濾波參數為0.5~500 Hz,并使用CED1401 Ⅱ和Spike2軟件(Cambridge Electronic Design,UK)對信號進行模數轉換和采集,采樣頻率為2 000 Hz。實驗獲得當地道德倫理委員會批準許可,數據已得到英國牛津大學功能神經外科研究組授權使用。
信號預處理對信號進行90 Hz抗混疊低通濾波(切比雪夫Ⅰ型濾波器),信號統一降采樣至1 000 Hz,采用自適應迭代濾波器濾除50 Hz工頻干擾,最后進行3 Hz高通濾波去除低頻噪聲(切比雪夫Ⅰ型濾波器)。
1.2 功率譜分析
場電位信號各頻率成分的幅度分布使用平均功率譜分析方法進行計算,度量局部場電位信號各頻段的同步化特征。功率譜分析使用Welch算法,選用2 s的Hamming數據窗、數據窗重疊長度為1 s,快速傅里葉變換點數為2 048。 首先計算25 s局部場電位信號的功率譜密度,然后通過統計學分析在各頻率段比較服藥前后功率譜密度的變化,確定藥物對局部場電位信號同步化特征的顯著性影響。
1.3 時頻分析
短時傅里葉變換用于觀察局部場電位信號不同成分的幅度隨時間的變化情況[13]。本文使用短時傅里葉變換研究局部場電位信號的動態時變特性,窗長0.25 s,重疊0.2 s,快速傅里葉變換點數為2 048,時頻分析結果的時間分辨率為0.25 s,頻率分辨率約為4 Hz。
1.4 變異系數分析
變異系數(coefficient of variation,CV)指樣本標準差與平均值的百分比,反映信號相對波動程度。本文使用變異系數這一參數表示局部場電位信號各成分的穩定程度,變異系數隨數據長度增加而收斂,25 s場電位信號長度保證了該變量的計算可靠性。首先以1 Hz為單位在短時傅立葉變換的時頻譜中對頻率積分,得到在各頻率的信號幅度隨時間變化的曲線,然后計算各頻率下時變幅度的標準差和平均值,進而計算變異系數,得到變異系數頻率分布曲線。
1.5 統計分析
本文使用Wilcoxon秩檢驗對各指標在服藥前后進行統計學比較分析。Wilcoxon秩檢驗是非參數檢驗的一種,它對樣本總體分布沒有嚴格要求,且Wilcoxon秩檢驗通過計算樣本排序等級對差異性進行評估,避免了少數大幅度樣本的干擾。文中通過對服藥前后兩組數據進行Wilcoxon秩檢驗,確定在各頻段的功率譜密度或變異系數在服藥前后的差異是否具有統計學意義。
2 結果
2.1 同步化特征分析
丘腦底核局部場電位具有多頻率成分,包含豐富的生理病理相關信息。其中,與帕金森病密切相關的頻段主要有Theta(4~7 Hz)、Alpha(8~12 Hz)、 Beta(13~30 Hz)和Gamma(30~90 Hz)等頻段,一些頻段還可細分為低Beta(13~20 Hz)、高Beta(20~30 Hz)、低Gamma(30~60 Hz)以及高Gamma(60~90 Hz)。藥物對局部場電位各頻段神經波動具有不同影響(圖1),場電位信號各頻率成分的幅度隨時間而起伏,服藥后場電位信號Beta成分幅度明顯下降。
 圖1
丘腦底核局部場電位原始信號及各頻段的濾波信號
圖1
丘腦底核局部場電位原始信號及各頻段的濾波信號
LFPs:局部場電位原始信號;Hγ:高Gamma頻段;Lγ:低Gamma頻段;Hβ:高Beta頻段;Lβ:低Beta頻段;α:Alpha頻段;θ:Theta頻段
Figure1. Original subthalamic local field potentials and components of each frequency bandLFPs: original local field potentials; Hγ: high gamma component; Lγ: low gamma component; H β: high beta component; Lβ : low beta component; α: alpha component; θ: theta component
采用信號的功率譜分析可以對神經活動幅度的同步化特征進行定量分析,并通過比較服藥前后信號功率譜密度度量藥物對同步化特征的影響,同時使用Wilcoxon秩檢驗的方法檢驗服藥前后功率譜密度,確定受藥物顯著影響的頻段(圖2)。結果表明,在不服藥狀態下,神經活動具有低頻、低Beta、高Beta等明顯譜峰[圖2(a)];為減少記錄環境、記錄條件等外界因素的干擾,對功率譜密度進行積分得到各信號的總功率,以功率譜密度除以總功率對其進行歸一化處理,在歸一化譜上4~7 Hz、8~10 Hz、10~22 Hz、22~30 Hz等頻段更為明顯[圖2(b)]。多巴胺類藥物顯著抑制了13~20 Hz的低Beta成分的幅度,提高了4~7 Hz的Theta成分[P<0.05,圖2(a)]。在歸一化譜上進一步可見服藥后低Beta成分顯著降低,以及Theta成分顯著升高[P<0.05,圖2(b)],服藥后高Gamma頻段同步化有所增高,但差異未見統計學意義[圖2(b)]。
 圖2
各頻率處局部場電位信號的功率譜密度均值以及服藥前后的統計學分析結果
圖2
各頻率處局部場電位信號的功率譜密度均值以及服藥前后的統計學分析結果
(a)功率譜絕對值的統計結果;(b)歸一化功率譜統計結果,其中陰影代表±標準差
Figure2. Average power spectra of subthalamic local field potentials at each frequency band and the statistical significance between the on- and off-medication states(a) results of absolute power spectra density; (b) results of normalized power spectra density,the shadow represents ±standard deviation
為進一步觀察低Beta和Theta頻段受藥物影響的同步化特征的個體化分布,計算了兩個頻段內的平均幅度并進行統計分析(圖3)。結果表明低Beta頻段信號幅度服藥后顯著降低[P<0.01,圖3(a)],Theta頻段幅度明顯升高[P<0.01,圖3(c)]。歸一化結果進一步證實低Beta和Theta頻段均發生顯著改變[P<0.001,圖3(b);P<0.001,圖3(d)]。在所有數據中Beta成分降低的比例為76%,Theta成分增高的比例為83%。
 圖3
受藥物顯著影響頻段的能量變化情況
圖3
受藥物顯著影響頻段的能量變化情況
(a)低Beta同步化;(b)歸一化低Beta同步化;(c)Theta同步化;(d)歸一化Theta同步化
Figure3. Power change at frequency bands significantly affected bymedication(a) low beta synchronization; (b) normalized low beta synchronization; (c) theta band synchronization; (d) normalized theta band synchronization
2.2 動態時變特性分析
丘腦底核場電位的Theta和低Beta成分的幅度受藥物顯著影響,各神經波動成分具有動態時變特性[圖4(a)(b)],其動態穩定性亦受到藥物影響。本文使用時變幅度的變異系數來度量其動態穩定特性[圖4(c)]。服藥后0~90 Hz各神經活動成分的波動性有所改變,其中4~10 Hz、10~22 Hz、60~70 Hz頻段波動性升高,22~30 Hz、45~55 Hz頻段波動性降低。經統計學檢驗,4~7 Hz的Theta成分和60~66 Hz的Gamma成分具有顯著變化[P<0.05,圖4(c)]。為進一步觀察Theta成分和高Gamma成分受藥物影響的動態特征的個體化分布,計算了兩個頻段內的積分所得信號幅度的變異系數并進行統計分析。結果表明Theta成分和高Gamma成分的波動性均顯著升高(P<0.05,圖5)。在所有數據中Theta成分變異系數上升的比例為76%[圖5(a)],高Gamma成分變異系數上升的比例為69%[圖5(b)]。
 圖4
服藥前后各頻段局部場電位信號能量的穩定性
圖4
服藥前后各頻段局部場電位信號能量的穩定性
(a)(b)為服藥前后局部場電位信號的短時傅里葉變換;(c)為時變能量變異系數頻率分布曲線和服藥前后變異系數的統計學分析,其中陰影代表±標準差
Figure4. Dynamic characteristics of subthalamic local field potentials at each frequency band(a) (b) short-time Fourier transform of subthalamic local field potentials; (c) coefficient of variation of the time-variant power and the statistical significance,and the shadow represents ±standard deviation
 圖5
受藥物顯著影響頻段時變能量變異系數的變化情況
圖5
受藥物顯著影響頻段時變能量變異系數的變化情況
(a)Theta頻段;(b)高Gamma頻段
Figure5. Change of coefficients of variation of time-variant power at frequency bands significantly affected by medication(a) theta band; (b) high gamma band
3 討論與結論
神經核團活動具有多頻率神經波動成分,亦展現出同步化、動態性等特征[12]。以往的工作研究了其同步化特征,而本文則結合動態時變性、個體化等多方面信息,以期對丘腦底核功能提供更為全面的整體分析。
目前關于藥物對神經波動的影響研究主要集中在同步化特征上[11]。Alonso-Frech等[11]發現服藥后11~30 Hz頻段同步化被顯著抑制,而4~10 Hz和60~80 Hz頻段同步化升高。本文結果進一步證明僅13~20 Hz的低Beta成分降低與藥物影響密切相關,而20~30 Hz的高Beta成分則未見明顯改變,提示神經波動成分具有更為精細的功能區分,低、高Beta成分應具有不同的功能。
場電位信號的時頻分析結果表明丘腦底核神經波動具有顯著的時變特性。本文通過分析藥物對丘腦底核神經波動穩定性的影響,發現服藥后4~7 Hz和60~66 Hz頻段的波動性顯著升高。文獻報道4~7 Hz頻段的神經波動負責傳輸非自主運動信號到丘腦皮層運動區[14],本研究則說明藥物使得低頻神經活動同步化程度增高、穩定性降低,這有可能是藥物引起帕金森病異動癥狀的原因之一。此外,有研究發現Gamma頻段神經活動與運動反應時間[15]和認知[16]有關,本文發現服藥后該頻段的波動性提高,提示帕金森病患者用藥后運動反應以及認知能力提高可能與其有關。
帕金森病及其治療均與丘腦底核的神經活動密切相關,本文研究表明丘腦底核的幅度同步化程度以及幅度的穩定性均顯著受到藥物影響。一方面可將上述多個特征與臨床評價指標進行融合,形成與帕金森病治療相關的更為敏感和特異的神經生物標記物;另一方面這些指標亦可用于帕金森病患者的腦功能狀態判定,進而為帕金森病閉環深部腦刺激反饋算法提供判別依據。